Введение
Настоящая статья представляет собой структурно и визуально адаптированную версию клинических рекомендаций по теме «Геморрагический инсульт», утверждённых Министерством здравоохранения Российской Федерации.
В процессе подготовки материала оригинальный текст не менялся, в целях улучшения навигации и удобства восприятия информации менялось лишь форматирование. В целях повышения прикладного значения данного материала были удалены разделы, не относящиеся к ежедневной клинической работе специалиста (в частности, приложения А1 [Состав рабочей группы], А2 [методология разработки клинических рекомендаций] и уровни рекомендаций).
Содержательная часть клинических рекомендаций оставлена без изменений: структура, формулировки и клинические положения полностью соответствуют официальному документу.
Список сокращений
- АГМ – аневризма головного мозга
- АВМ – артериовенозная мальформация
- АД – артериальное давление
- АКБМ – артериальный круг большого мозга
- аСАК – аневризматическое САК
- ВМГ – внутримозговая гематома
- ВЖК – внутрижелудочковое кровоизлияние
- ВСА – внутренняя сонная артерия
- ВЧГ – внутричерепная гипертензия
- ВЧД – внутричерепное давление
- ГИ – геморрагический инсульт
- ДТЧ – декомпрессивная трепанация черепа
- ЗНМА – задняя нижняя мозжечковая артерия
- ИВЛ — искусственная вентиляция легких
- КТ – компьютерная томография
- КТА – компьютерно-томографическая ангиография
- ЛСК – линейная скорость кровотока
- МЕ – международные единицы
- МНО – международное нормализованное отношение
- МРА – магнитно-резонансная ангиография
- МРТ – магнитно-резонансная томография
- НВД – наружный вентрикулярный дренаж
- ОНМК — острое нарушение мозгового кровообращения
- ПМА – передняя мозговая артерия
- ПСА – передняя соединительная артерия
- САК – субарахноидальное кровоизлияние
- САД – систолическое артериальное давление
- СМА – средняя мозговая артерия
- СРХ – стереотаксическая радиохирургия
- СДГ – субдуральная гематома
- ТКДГ – транскраниальная допплерография
- ТМО – твердая мозговая оболочка
- ЦА – церебральная ангиография
- ЦВ – церебральный вазоспазм
- ЦПД – церебральное перфузионное давление
- ЦВ – церебральный вазоспазм
- ЧМН – черепно-мозговые нервы
- ЧСС – частота сердечных сокращений
- ШКГ – шкала комы Глазго
- ЭКГ – электрокардиография
- S-M – классификация Spetzler-Martin
Термины и определения
- Локальный фибринолиз гематомы – введение ферментных препаратов в толщу внутримозговой гематомы путем стереотаксической пункции для более быстрого ее перехода из плотной в жидкую форму и последующей аспирации через тонкий катетер.
- Открытое удаление внутримозговой гематомы – удаление внутримозговой гематомы путем трепанации черепа и энцефалотомии.
- Эндоскопическая аспирация внутримозговой гематомы – удаление внутримозговой гематомы путем трефинации черепа и использования мини-доступов при помощи эндоскопическогооборудования.
- Эндоваскулярная эмболизация АВМ – суперселективное введение в афференты и ядро мальформации неадгезивных, быстротвердеющих клеевых композиций и спиралей.
- Радиохирургия АВМ – стереотаксическое облучение мальформаций на аппарате “гамма-нож” или линейном ускорителе при помощи гамма-частиц, протонов или (значительно реже) альфа-частиц.
1. Краткая информация
1.1 Определение
Геморрагический инсульт – полиэтиологическое заболевание, включающее все формы нетравматического внутричерепного кровоизлияния
Субарахноидальное кровоизлияние (САК) – одна из форм геморрагического инсульта, характеризующаяся распространением крови из кровеносного русла в субарахноидальное пространство (между мягкой и паутинной оболочками) головного мозга.
Аневризма головного мозга (АГМ) – это патологическоерасширение просвета артерии головного мозга, обусловленное истончением мышечного слоя стенки сосуда на фоне сохранных интимы и адвентициального слоев. Следствием разрыва АГМ в подавляющем большинстве случаев является САК, которое может сопровождаться внутримозговой гематомой (ВМГ) и внутрижелудочковым кровоизлиянием (ВЖК).
Артериовенозная мальформация – вариант сосудистых ангиоматозных пороков развития нервной системы, является следствием диспластического метаморфоза, инициированного неизвестными факторами. Следствием разрыва АВМ являются внутримозговая гематома ВМГ, САК или ВЖК.
1.2 Этиология и патогенез
Выделяют первичные и вторичные внутримозговые кровоизлияния. Гематома, возникающая в результате артериальной гипертонии, является первичным кровоизлиянием, и наблюдается в 70-90% [1].
При вторичном кровоизлиянии гематома возникает вследствие следующих причин [2,3,4]:
- разрыва АВМ (46%);
- разрыва аневризмы с формированием ВМГ (22%);
- тромбоза венозных синусов и корковых вен (17%);
- разрыва дуральных артериовенозных фистул (9%);
- васкулопатий (3%);
- болезни Моя-Моя (3%);
- кровоизлияния в опухоль (1%).
Внутримозговая гематома может образоваться также вследствие повышения интенсивности кровотока и проницаемости микроциркуляторного русла в области инфаркта мозга. Описана возможность формирования внутримозговых кровоизлияний как осложнения инфекционных заболеваний центральной нервной системы и эклампсии [1,3].
Гипертензивная гематома возникает в результате проникновения крови из патологически измененной артерии в вещество головного мозга. Небольшие по диаметру артерии, из которых происходит кровоизлияние, расположены в области базальных ядер, таламуса, варолиева моста, а также у поверхности мозга, не имеют развитых анастомозов, являясь часто конечными ветвями. Возможности перераспределения крови и адаптации к изменениям гемодинамики у этих артерий минимальны. В связи с этим, длительная артериальная гипертония и атеросклероз приводят к выраженным изменениям их стенок. В результате развивающегося липогиалиноза, фибриноидного некроза и истончения мышечного слоя упругость сосудистой стенки уменьшается, а проницаемость увеличивается. Нередко формируются микроаневризмы [5].
Существуют два механизма развития кровоизлияния: по типу гематомы и по типу диапедезного пропитывания. Кровоизлияния по типу гематомы встречаются в 85% случаев по материалам аутопсий, имеют типичную локализацию в подкорковых ядрах, полушариях мозга и мозжечке. При данном типе кровоизлияния излившаяся кровь раздвигает мозговое вещество, что сопровождается перемещением отдельных участков мозга. В связи с этим, в первые часы не происходит значительного разрушения мозгового вещества. При кровоизлиянии по типу гематомы размеры гематомы намного превышают объем разрушенной ткани. Кровоизлияния по типу диапедеза встречаются значительно реже, являясь чаще всего следствием системных изменений сосудистой стенки и увеличения ее проницаемости и/или системных изменений гемостаза. Такие кровоизлияния чаще имеют небольшие размеры и располагаются преимущественно в таламусе или варолиевом мосту [6].
Наиболее частой причиной САК является АГМ.
При возникновении АГМ выделяют предрасполагающие врожденные факторы и приобретенные факторы.
К предрасполагающим генетическим факторам относят изменения в генах, отвечающих за синтез структурных элементов сосудистой стенки. Выявлен ряд наследственных заболеваний, ассоциирующихся с высокой частотой встречаемости (от 5 до 40%) АГМ у таких пациентов: синдром Эллерса-Данло (тип IV), синдром Марфана, нейрофиброматоз I типа, аутосомно-доминантная поликистозная болезнь почек.
Выделяют так называемые семейные АГМ – у 7-20% пациентов с аневризматическим САК родственники первой или второй степени родства также имеют АГМ.
К приобретённым факторам относят наличие артериальной гипертензии, атеросклероз. Среди факторов риска формирования АГМ также выделяют курение, тяжелые формы алкогольной зависимости, женский пол [7-15].
В ряде случаев можно связать формирование АГМ с тяжелой черепно-мозговой травмой, инракраниальной инфекцией или с расширением артерий при артериовенозной мальформации головного мозга.
АВМ могут возникать как внутриутробно, так и после рождения. Наиболее частой генетической причиной эмбрионального формирования АВМ является наследственная геморрагическая телеангиэктазия. Мутация генов, кодирующих клеточные рецепторы эндоглин и ALK1, инактивирует сигнальный путь с участием трансформирующего фактора роста β1, обладающего антипролиферативной активностью [16]. АВМ выявляют у 9-16% людей с наследственной геморрагической телеангиоэктазией [17,18]. Другой генетической причиной является мутация гена RASA1 [19].
Несмотря на преимущественно врожденный характер, ряд АВМ могут образовываться после рождения и расти в течение жизни. Об этом свидетельствует обнаружение мальформаций при повторной ангиографии, выполненной через несколько лет после первичной ЦА или МРТ, при которых АВМ отсутствовала [20]. Причиной развития приобретенных мальформаций считается асимптомный венозный тромбоз, приводящий к локальной венозной гипертензии, ишемии и выработке эндотелиального фактора роста сосудов, уровень которого повышен при наличии АВМ [21].
Кровоизлияние из АВМ является наиболее частым вариантом ее клинических проявлений и происходит, в среднем, у 50% пациентов [22].Высокое артериальное давление в афферентах АВМ [23] и несбалансированность притока и оттока крови являются главными факторами риска ее разрыва [24]. Чаще наблюдают кровоизлияниеиз небольшихмальформаций [25,26]. В больших АВМ из-за низкого периферического сосудистого сопротивления развивается эффект “обкрадывания” кровотока из рядом расположенных сосудов мозга. Данный синдром, отсутствие нормального гематоэнцефалического барьера между сосудами АВМ и головным мозгомивенозная гипертензиявследствие обструкции венозного оттока препятствуют адекватному газообмену, что приводит к ишемии ткани мозга рядом с высокопоточными мальформациями[27,28].По этой причинерасположение АВМ в функционально значимых зонах мозга часто приводит к смещениюэтих центров в соседние отделы или в противоположное полушарие [29]. Длительная ишемия и пульсация сосудов АВМ приводят к развитию судорог, обычно наблюдаемых при мальформациях большого размера с распространением на кору мозга [30].
1.3 Эпидемиология
Геморрагический инсульт составляет 10-15% от всех видов нарушения мозгового кровообращения. Только в Российской Федерации каждый год диагностируют ГИ у 43 000 человек. Средний возраст пациентов с ГИ — 60-65 лет, соотношение мужчин и женщин равно 1,6:1. Риск развития ГИ значительно повышается после 55 лет и удваивается с каждым последующим десятилетием. Летальность от ГИ достигает 40-50%, а инвалидность развивается у 70-75% выживших. Факторами риска в развитии ГИ являются высокое артериальное давление, злоупотребление алкоголем, наличие в анамнезе предыдущих нарушений мозгового кровообращения, а также нарушения функции печени, сопровождающиеся тромбоцитопенией, гиперфибринолизом и уменьшением факторов свертывания крови [1,4,6].
АГМ встречаются в 1-5% при аутопсийных исследованиях, однако частота разрывов АГМ намного меньше и составляет 2 – 20 случаев на 100 000 человек в год [13,14,31,33]. САК чаще происходит у женщин (частота 3:2). Пик заболеваемости приходится на возрастной период от 40 до 60 лет.
Частота встречаемости АВМ среди населения по разным данным варьирует от 0,015% до 0,14% [33,34].Разрыв мальформации происходит у наиболее молодых пациентов в сравнении с другими сосудистыми аномалиями [35]. Манифестация заболевания характерна для 20-45 лет. Кровоизлияние из АВМ является самой частой причиной ВМГ у пациентов моложе 45 лет [36]. Средний риск разрыва АВМ составляет 2-4% в год [22].Вероятность кровоизлияния в течение всей жизни варьирует от 17% до 90% [35]. Риск кровоизлияния повышают глубинная локализация АВМ, ее дренирование в вену Галена и геморрагический анамнез. При отсутствии указанных факторов риск разрыва мальформации составляет 0,9%, при их комбинации – 34% [37].
Для более точного расчета вероятности кровоизлияния из АВМ в течение жизни пациента применяют формулу, предложенную KondziolkaD. с соавт. (1995) [38]: Риск кровоизлияния из АВМ в течение жизни = 1 – (вероятность того, что кровоизлияние не произойдет) предполагаемая продолжительность жизни (годы). Комментарий: “вероятность того, что кровоизлияние не произойдет” = (100 – риск разрыв в год (%))/100.
Для облегчения расчета можно использовать упрощенную формулу [39]: Риск кровоизлияния из АВМ в течение жизни = 105 – возраст пациента
1.4 Кодирование
МКБ–10.
- I60 –Субарахноидальное кровоизлияние:
- I60.0 – Субарахноидальное кровоизлияние из ствола внутренней сонной артерии синуса и бифуркации
- I60.1 – Субарахноидальное кровоизлияние из средней мозговой артерии
- I60.2 – Субарахноидальное кровоизлияние из передней соединительной артерии
- I60.3 – Субарахноидальное кровоизлияние из задней соединительной артерии
- I60.4 – Субарахноидальное кровоизлияние из базилярной артерии
- I60.5 – Субарахноидальное кровоизлияние из позвоночной артерии
- I60.6 – Субарахноидальное кровоизлияние из других внутричерепных артерий
- I60.7 – Субарахноидальное кровоизлияние из внутричерепной артерии неуточненной
- I60.8 – Другое субарахноидальное кровоизлияние.
- I60.9 – Субарахноидальное кровоизлияние с неуточненной причиной
- I61 – Внутримозговое кровоизлияние:
- I61.0 – Внутримозговое кровоизлияние в полушарие субкортикальное
- I61.1 – Внутримозговое кровоизлияние в полушарие кортикальное
- I61.2 – Внутримозговое кровоизлияние в полушарие неуточненное
- I61.3 – Внутримозговое кровоизлияние в ствол мозга
- I61.4 – Внутримозговое кровоизлияние в мозжечок
- I61.5 – Внутримозговое кровоизлияние внутрижелудочковое
- I61.6 – Внутримозговое кровоизлияние множественной локализации
- I61.8 – Другое внутримозговое кровоизлияние
- I61.9 – Внутримозговое кровоизлияние неуточненное
- I62 –Другое нетравматическое внутричерепное кровоизлияние:
- I62.0 –Субдуральное кровоизлияние (острое) (нетравматическое)
- I62.1 –Нетравматическое экстрадуральное кровоизлияние
- Нетравматическое эпидуральное кровоизлияние
- I62.9 –Внутричерепное кровоизлияние (нетравматическое) неуточненное
- Q28.2 –Артериовенозный порок развития церебральных сосудов.
1.5 Классификация
Классификация ГИ
Существует несколько классификаций ГИ в зависимости от расположения кровоизлияния. Одни подробные и описывают все возможные варианты локализации гипертензивных гематом, в том числе и отдельные классификации для разных областей мозга (больших полушарий, ствола, мозжечка), другие более лаконичны и подразделяют ВМГ на меньшее количество форм в зависимости от расположения основного объема ВМГ и места ее возникновения [1].
Согласно наиболее распространенной классификации ГИ, объединяющей положения несколько других, в зависимости от формы и локализации ВМГ подразделяют на следующие типы:
- Путаменальная гематома — гематома, располагающаяся в области подкорковых ядер, латерально относительно внутренней капсулы;
- Таламическая гематома — гематома таламуса, располагается медиально относительно внутренней капсулы;
- Смешанная гематома — гематома подкорковых ядер, охватывающая область латеральнее и медиальнее внутренней капсулы, или с субкортикальным и глубинным расположением;
- Субкортикальная гематома – гематома, расположенная близко к коре головного мозга;
- Гематома мозжечка — гематома полушарий и/или червя мозжечка;
- Гематома ствола мозга.
Классификация периодов САК
Выделяют 3 основных периода аСАК.
- Острый период – 14 дней с момента последнего САК (период, в течение которого чаще всего происходит ухудшение пациентов на фоне отека, вазоспазма и ишемии головного мозга). В этом периоде выделяют острейший период (0-72 часа), когда у пациента клинические проявления обусловлены именно кровоизлиянием (до возникновения вазоспазма).
- Подострый период – 15 — 31 дней с момента последнего САК (период, в течение которого регрессируют основные осложнения САК).
- Холодный период – 1 мес и более с момента САК (период, когда могут наблюдаться остаточные нарушения, связанные с перенесенным САК).
Классификация аневризм
- По месту возникновения различают бифуркационные и стволовые АГМ, по форме – мешотчатые (около 90% АГМ, одно- или многокамерные) и фузиформные.
- По количеству АГМ делаться на одиночные (80%) и множественные (20%).
- По размеру выделяют милиарные аневризмы (до 3 мм), среднего размера (3-14 мм), большого размера (15-24 мм) и гигантские АГМ (25 и более мм).
- 90% АГМ располагаются в передних отделах АКБМ, 10% — в задних отделах (вертебробазилярном бассейне) АКБМ.
Классификации артериовенозных мальформаций
Наиболее распространенной классификацией АВМ является шкала Spetzler-Martin (S-M), предложенная R.F. Spetzler и N.A. Martin в 1986 году [40]. Классификацию применяют для прогнозирования осложнений при хирургическом лечении мальформаций. Шкала учитывает 3 наиболее значимых параметра, влияющих на исход: размер, дренирование и локализацию мальформации (см. приложение XIX).
При резекции АВМ 1-2 балла по S-M риск осложнений низкий, 3 балла вариабельный, 4-5 баллов – высокий.Дополнительно введенный шестой балл означает неоперабельную мальформацию.
LawtonM.T. с соавт. (2003) предложили модифицированную классификацию для АВМ 3 балла по S-M [41]. Перечислив все возможные комбинации составляющих параметров, данные мальформации разделяют на:
- S1V1E1 – мальформации размером менее 3 см, дренирующиеся в глубинные вены и расположенные в значимой зоне;
- S2V1E0 – АВМ 3 см и более с глубинным дренированием в незначимой зоне мозга;
- S2V0E1 – образования диаметром 3 см и более без глубинного венозного оттока в функционально значимой зоне;
- S3V0E0 – мальформации более 6 см без глубинных эфферентов вне важной зоны.
Результаты хирургии АВМ S1V1E1 сопоставимы с исходами операций при мальформациях 1-2 балла по S-M, их причисляют к подтипу III-. При мальформациях S2V1E0 (подтип III) исходы вариабельны. Результаты оперативного лечения мальформаций S2V0E1 неудовлетворительные, такие АВМ относят к подтипу III+. Мальформации S3V0E0 (подтип III*) не встречаются.
На результаты хирургии АВМ также влияют возраст пациента, размытость мальформации и анамнез заболевания. Учитывая данные факторы, LawtonM.T. с соавт. в 2010 году предложили шкалу, названную дополнительной классификацией Spetzler-Martin или классификацией Lawton-Young[42] (см. приложение XIX).
Суммируя основную и дополнительную шкалы S-M, получают комбинированную шкалу S-M, более точно прогнозирующую исход хирургического лечения. При выключении из кровотока АВМ 2-6 баллов риск осложнений низкий (0-24%), 7-10 баллов – высокий (39-63%) [43]. В настоящий момент классификация Lawton-Young наиболее точно прогнозирует исход хирургического лечения АВМ [44].
Для облегчения градации АВМ Spetzler R.F. и Ponce F.A. в 2011 году предложили классификацию, названную Spetzler-Ponce [45]. Принимая во внимание схожесть клинических исходов при хирургии АВМ, оцененных в 1 и 2 балла по S-M, а также в 4 и 5 баллов, все мальформации разделяют на 3 класса:
- класс A – мальформации1 и 2 балла по S-M;
- класс B –АВМ3 балла по S-M;
- класс C – мальформации 4 и 5 баллов по S-M.
Для прогнозирования вероятности осложнения при эмболизации АВМ применяют классификацию Buffalo score (2015) (см. приложение XIX). Шкала оценивает количество ножек афферентов, их размер и расположение мальформации. При увеличении количества баллов по Buffalo score возрастает количество периоперационных осложнений (с 0 до 75%) [46].
При радиохирургии АВМ на гамма-ноже применяют шкалы Radiosurgery-based AVM score (RBAS, шкала Pollock-Flickinger, 2002 и 2008)[47,48] и Virginia radiosurgery AVM scale (VRAS, шкала Virginia, 2013) [49]. Обе шкалы оценивают радикальность облитерации мальформации и функциональных исход.
Градация АВМ по RBAS (2002) = 0,1 x (объем АВМ в мл) + 0,02 x (возраст пациента в годах) + 0,3 x (локализация мальформации*)
*Локализация АВМ:
- 0 баллов – лобная и височная доли
- 1 балл – теменная, затылочная доли, внутрижелудочковое расположение, мозолистое тело и мозжечок
- 2 балла – базальные ядра, таламус, ствол мозга.
Оценка АВМ по RBAS (2008, модифицированный вариант) = (0,1)x(объем АВМ в мл) + (0,02)x(возраст пациента в годах) + (0,5)x(расположение мальформации*).
*Локализация АВМ:
- 0 баллов – лобная и височная доли
- 1 балл – теменная, затылочная доли, внутрижелудочковое расположение, мозолистое тело и мозжечок
- 2 балла – базальные ядра, таламус, ствол мозга.
Классификация VRAS включает в себя объем АВМ, ее локализацию и анамнез заболевания (см. приложение XIX).
С увеличением количества баллов снижается вероятность тотальной облитерации АВМ и количество хороших функциональных исходов при всех трех шкалах.
Для прогнозирования радикальности облитерации АВМ и определения дозы радиации при облучении на линейном ускорителе применяют Шкалу Heidelbergscore (2012) [50].Учитывают размер мальформации и возраст пациента. Результат расчитывают таким образом:
- 1 балл – возраст пациента 50 лет и менее и размер АВМ менее 3 см;
- 2 балла – возраст пациента более 50 лет или размер мальформации 3 см и более;
- 3 балла – возраст пациента более 50 лет и размер мальформации 3 см и более.
Увеличение балла по данной шкале на 1 приводит к снижению вероятности облитерации на 44%.
Для оценки полноты закрытия АВМ при ее однократном облучении на протонном пучке применяют шкалу ProtonradiosurgeryAVMscale (PRAS, 2014) [50]. Оценивает объем и локализацию АВМ.
Градация АВМ по PRAS= 0,26 x (объем АВМ в мл) + 0,7 x (локализация АВМ*)
*Локализация АВМ
- 0 баллов – поверхностныеАВМ (лобная, височная, теменная, затылочная доли, внтурижелудочковая локализация, мозолистое тело, мозжечок).
- 1 балл – глубинная локализации АВМ (базальные ядра, таламус, ствол мозга).
С увеличением балла по PRAS снижается вероятность облитерации АВМ.
1.6 Клиническая картина
Клинические проявления и течение гипертензивной гематомы разнообразны [9]. Симптоматика развивается, как правило, внезапно, обычно днем. Наиболее частые провоцирующие факторы — подъем АД, прием алкоголя, физические нагрузки, горячая ванна. Общемозговые расстройства являются ведущими. Развивается резкая головная боль, нередко тошнота и рвота. Возможно возникновение эпилептического приступа. Может наблюдаться психомоторное возбуждение. Часто наблюдается снижение бодрствования различной степени выраженности.
Менингеальная симптоматика в первые часы представлена преимущественно светобоязнью, скуловым симптомом Бехтерева. В дальнейшем появляется ригидность мышц затылка, симптомы Кернига, Брудзинского. У пожилых пациентов в 1/3 случаев раздражение мозговых оболочек не выявляют.
Вегетативная симптоматика представлена гиперемией кожных покровов, потливостью, хриплым дыханием, которое при нарушении бодрствования может становиться стридорозным или типа Чейна-Стокса, напряжением пульса и повышением АД.
Очаговая симптоматика зависит от локализации ВМГ. Субкортикальные ВМГ, расположенные близко к центральным извилинам или распространяющиеся на подкорковую область, путаменальные и смешанные ВМГ обычно проявляются контралатеральным гемипарезом различной выраженности, гемианестезией, гемианопсией, парезом лицевой мускулатуры и языка по центральному типу. При поражении доминантного полушария возникают нарушения речи, субдоминантного – нарушения «схемы тела», анозогнозия. При кровоизлияниях в таламус возникает контралатеральная гемигипестезия и гемиатаксия, гемианопсия, гемипарез. Возможны сонливость и апатия. При субкортикальных гематомах, расположенных вдали от центральных извилин, развивается симптоматика поражения соответствующих долей большого мозга. для кровоизлияний в мозжечок характерны выраженное головокружение, нистагм, резкая боль в затылке, атаксия, гипотония мышц. При ВМГ мозжечка значительного объема возникает прямое сдавление ствола мозга с поражением нервов и проводящих путей ствола, нарушением функции дыхания и гемодинамики, или окклюзионная гидроцефалия, с развитием окклюзионно-дислокационного синдрома. Важно помнить, что при отсутствии развернутой картины окклюзионно-дислокационного синдрома, симптоматика поражения мозжечка не всегда четко проявляется при осмотре пациента в положении лежа. Кровоизлияние в ствол мозга (чаще, варолиев мост) сопровождается поражением ядер черепно-мозговых нервов и проводящих путей ствола, возникают альтернирующие синдромы, часто ВМГ ствола сразу приводят к развитию комы и нарушений витальных функций.
Прорыв крови в желудочковую систему (изолированное ВЖК или прорыв ВМГ) возникает у половины пациентов. Клинические проявления ВЖК разнообразны и зависят от объема излившейся в желудочки крови. Для ВЖК характерны гипертермия, гиперсаливация. Окклюзия ликворопроводящих путей сопровождается развитием окклюзионно-гипертензионного синдрома, при массивном ВЖК возникает нарушение бодрствования, горметония, мышечная гипотония, расстройства дыхания и гемодинамики.
Дислокационный синдром развивается при ВМГ значительного объема, чаще височной локализации и сопровождается нарушением бодрствования, анизокорией с мидриазом на стороне поражения, сменой полушарного пареза взора на стволовой, расстройствами дыхания и сердечно-сосудистой деятельности [51].
У лиц старшего возраста и/или при небольших, ограниченных белым веществом головного мозга, гематомах общемозговые и менингеальные симптомы могут быть мало выражены или отсутствовать, а в клинической картине преобладают очаговые симптомы.
Критерии диагноза геморрагический инсульт:
- клиническая картина заболевания: остро возникшая очаговая и менингеальная симптоматика
- данные нейровизуализации (предпочтительна компьютерная томография): внутримозговая гематома, не связанная с травмой, разрывом аневризмы и сосудистой мальформации, кровоизлиянием в опухоль
Комментарии: при подозрении на вторичный характер геморрагического инсульта, в том числе и у страдающих артериальной гипертонией, требуется установление возможных причин кровоизлияния (коагулопатия (в т.ч. лекарственная), васкулопатия, эклампсия, заболевания крови и др.).
Выделяют типичные (70%) и атипичные (30%) проявления САК.
При типичном начале заболевания основным клиническим симптомом САК является внезапная, сильная головная боль (по типу «удара в голову»). Часто головная боль сопровождается рвотой, светобоязнью, кратковременной или длительной утратой сознания. Артериальное давление чаще повышено.
У 30% пациентов с разрывами АГМ наблюдается стертая или атипичная клиническая картина САК (ложномигренозная форма, ложногипертоническая форма, ложновоспалительная форма, ложнопсихотическая форма, ложнотоксическая форма, ложнорадикулярная форма).
Разрыв АВМ в 97% пациентов сопровождается развитием общемозгового синдрома. Менингеальный синдром наблюдают в 88%: в 60% он умеренно выражен, в 28% – грубый.У 42% пациентов при разрыве АВМ сознание ясное, у 44% происходит нарушение уровня бодрствования до оглушения, у 14% – до сопора и комы. Парезы мышц конечностей наблюдают в 53%, плегию – в 21% [52].
Очаговые неврологические нарушения и угнетение сознания при кровоизлиянии из АВМ возникают реже, чем при кровоизлиянии из аневризм или ГИ. Это связано с тем, что ВМГ при разрыве мальформации обычно не распространяются на внутреннюю капсулу, не всегда имеют большие размеры, течение заболевания редко осложняется развитием ангиоспазма, а разрыв глубинных эфферентов часто приводит к изолированным вентрикулярным кровоизлияниям. Кроме того, гематомарядомс ядром АВМ часто раздвигает паренхиму мозга и не повреждает его проводящие пути. Пациенты с разрывом АВМ наиболее молодые, что способствует их восстановлению [22,25].
Очаговые неврологические нарушения развиваются чаще при наличии ВМГ (52%), реже – при изолированном САК (41%), еще реже – при изолированном ВЖК (28%) [22].
В 28% кровоизлияние из АВМ клинически проявляет себя лишь общемозговым и менингеальным синдромом без очаговых неврологических нарушений. Такая клиническая картина требует дифференцировки с разрывом аневризмы головного мозга. В пользу разрыва мальформации у таких пациентов свидетельствует меньшая выраженность менингеального синдрома (в 65% он умеренно выражен), а у 20% пациентов можно выявить изменения мышечного тонуса, анизорефлексию и наличие патологических рефлексов [52].
Риск летального исхода при кровоизлиянии из АВМ составляет 10-30%, неврологические симптомы развиваются в 50%, из них стойкие сохраняются в 10-20% [22].При первом разрыве летальность составляет 14%, при втором – 21% при третьем – 25% [53].
2. Диагностика
Общая информация
Основные задачи ургентной диагностики, проводимой пациентам с острым внутричерепным кровоизлиянием сводятся к выявлению этиологического фактора кровоизлияния с акцентом на выявление его симптоматической природы (разрыв аневризмы или АВМ), оценке тяжести состояния пациента, определению характера и тяжести кровоизлияния, поскольку именно эти факторы определяют сроки хирургического вмешательства и прогноз заболевания.
Критерии установления диагноза:
- анамнестические данные,
- физикальное обследование
- лабораторные исследования,
- инструментальные исследования и др.
2.1 Жалобы и анамнез
Пациенты с геморрагическим инсультом полушарной локализации при сохраненном ясном сознании или его угнетении до оглушения обычно предъявляют жалобы на головную боль, рвоту, головокружение, а также слабость в конечностях (контралатеральных пораженному полушарию мозга), нарушение чувствительности, зрения и пр. У пациентов может развиваться один из видов афазии, тогда пациенты не могут предъявить жалобы. При локализации геморрагического инсульта в стволе мозга или в мозжечке могут добавляться жалобы на нарушение координации, глотания, двоение.
Анамнестически удается установить, что заболевание развивается остро, с подъема артериального давления, внезапной сильной головной боли, утраты сознания, иногда сопровождающегося судорогами в конечностях. У большинства пациентов возникновению ГИ предшествует длительно существующая, «не леченая» артериальная гипертензия, мочекаменная болезнь и ожирение.
- При опросе пациента рекомендуется обратить внимание на сроки развития симптомов, остроту появления симптомов [54].
- Рекомендуется при неясном анамнезе у пациента с нарушенным бодрствованием прежде всего исключить черепно-мозговую и сочетанную травму [55].
2.2 Физикальное обследование
При неврологическом осмотре выявляются угнетение сознания различной степени выраженности, менингеальная симптоматика, очаговые симптомы (поражения черепных нервов, полушарные и стволовые симптомы).
- Для оценки тяжести состояния у пациентов с аСАК рекомендовано использовать следующие шкалы — шкала комы Глазго, Hunt-Hess, WFNS (см. Приложение Г) [213].
- Рекомендуется начать обследование всех пациентов с аСАК с общего осмотра, стандартной оценки тяжести состояния, систем органов и неврологического статуса [56].
- Рекомендуется использовать для оценки состояния шкалу инсульта Национальных институтов здоровья (Шкала NIHS), Канадскую шкалу тяжести неврологического состояния, системы прогностических баллов Аллена и др. [57- 61].
2.3 Лабораторные диагностические исследования
- Пациентам с нетравматическим внутричерепным кровоизлиянием, с целью исключения коагулопатиирекомендовано выполнить:
- общий (клинический) анализ крови [214, 215] и общий (клинический) анализ мочи [216],
- анализ крови биохимический общетерапевтический [217],
- коагулограмму (ориентировочное исследование системы гемостаза)[218],
- исследование агрегации тромбоцитов (при наличии анамнеза приема ангиагрегантов) [219,220].
Комментарии: изменение свертывающей системы крови в сторону гипокоагуляции может быть обусловлено как заболеванием (патология крови, печени и т.д.), так и приемом медикаментов и наблюдается чаще при вторичном характере ВМГ.
2.4 Инструментальные диагностические исследования
- При внутричерепных кровоизлияниях для уточнения его расположения и объема рекомендуется проведение КТ или МРТ головного мозга [62-65].
- Комментарии: Исследование необходимо выполнить в течение первых 2 часов от момента госпитализации.
- Объем кровоизлияния определяют либо с помощью программы, поставляемой производителем томографа, либо по формуле АВС/2, где А — наибольший диаметр, В — перпендикулярный диаметр по отношению к А, С — количество срезов х толщину среза. Пациентам, у которых во время хирургического вмешательства планируется использовать нейронавигацию, также производят сканирование в том режиме, который необходим для последующей передачи изображения на конкретную навигационную станцию [66,67].
- При выполнении КТ (МРТ) следует определить: наличие и топическое расположение патологического очага (очагов); объем каждого вида очага (гипо-, гиперденсивной части); положение срединных структур мозга и степень их смещения в мм; состояние ликворосодержащей системы мозга (величина, форма, положение, деформация желудочков) с определением вентрикуло-краниальных коэффициентов; состояние цистерн мозга; состояние борозд и щелей мозга. Степень выраженности САК оценивается по классификации Fisher и/или Hijdra. При наличии сопутствующего ВЖК используется шкала Graeb (см. XIX. Приложение Г).
- По характеру кровоизлияния в ряде случае следует подозревать наличие сосудистой аномалии с разрывом, как причины кровоизлияния. Для артериовенозных мальформаций характерно субкортикальное кровоизлияние (60%) с различной плотностью сгустков, неправильной формы, наиболее часто на стыке лобной и теменной, височной и затылочной долей; для артериальной аневризмы — в области основания лобной доли, сильвиевой щели, на стыке лобной и височной долей [52,68].
- САК возникает у 40% пациентов с кровоизлиянием из АВМ, чаще имеет место конвекситальное расположение и сочетается с ВМГ.Изолированное САК или его сочетание с ВЖК происходит в 4%, что следует отличать от разрыва аневризмы.ВЖК формируется в 56% [52]. Изолированное ВЖК (16%) является характерным признаком глубинной мальформации [69].
- СДГ наблюдают в 6% в комбинации с ВМГ. Изолированная СДГ образуется менее, чем у 1% пациентов с разрывом АВМ [52].
- АВМ на фоне кровоизлияния при бесконтрастной КТ выявляют в 9% [52]. Ее признаками являются расширенные или кальцинированные сосуды по краю ВМГ [70].
- При выявлении изолированной СДГ рекомендуется исключать ЧМТ, так как у больных без сознания и отсутствии данных анамнеза, СДГ может быть обусловлена травмой головы, о которой нет информации. [221].
- У пациентов с клиникой нетравматического внутричерепного кровоизлияния при отсутствии возможностей для проведения нейровизуализации рекомендовано выполнить поясничную пункцию для определения крови в цереброспинальной жидкости [222]
- Комментарий: При наличии клинических и/или инструментальных признаков дислокации поясничная пункция противопоказана.
- Для выявления источника кровоизлияния при подозрении на разрыв аневризмы или АВМ по данным КТ (МРТ) головного мозга, а также у пациентов моложе 45 лет и отсутствии гипертонического анамнеза рекомендуется выполнение одного из видов церебральной ангиографии[71,72]:
— КТА [223] или МРА [224]
— или ЦА [225]- Комментарии: Чувствительность КТА в выявлении АВМ и аневризмы на фоне кровоизлияния составляет 84-100% при специфичности 77-100% [69,73].
- Для отличия АВМ и аневризмы при КТ-ангиографии от “симптома пятна” рекомендуется выполнить отсроченную КТА через несколько минут после введения контрастного препарата [4].
- При проведении КТА у пациентов с ГИ часто наблюдают “симптом пятна” (spotsign), обусловленный экстравазацией контрастного препарата. При проведении КТА в первые 3 часа от начала заболевания вероятность этого симптома составляет 66%, через 6 часов снижается до 13% [4]. “Симптом пятна” является признаком нарастания объема ВМГ и ухудшает исход заболевания [74].
- При “симптоме пятна” происходит изменение его конфигурации и плотности из-за смешивания контрастного препарата с гематомой при повторном исследовании. При АВМ и аневризме этого не происходит, их плотность соответствует плотности рядом расположенных нормальных артерий при обоих исследованиях.
- Рекомендуется выполнение тотальной селективной церебральной ангиографии (ЦА) при недостаточной информативности КТА или МРА [225].
- Комментарий: “симптом пятна” при вторичном ГИ также возможен, но встречается реже: при разрыве АВМ его наблюдают в 14%, при аневризме ПМА – в 18%, при аневризме СМА – в 17% [4].Важно исследование всех четырех сосудистых бассейнов (внутренних сонных и позвоночный артерий с двух сторон). Она является наилучшим средством изучения ангиоархитектоники АВМ. Метод позволяет визуализировать кровоток по мальформации в динамике и оценить скорость его транзита. Вследствие эффекта шунтирования для высокопоточных мальформаций характерно заполнение артерий и вен в артериальную фазу. Выявление раннейдренирующей вены является характерным признаком, позволяющим заподозрить наличие ангиографически скрытой АВМ. Исходя из доказанных положений о большей эффективности ранних оперативных вмешательств, направленных на удаление сопутствующих АВМ гематом, а при благоприятных условиях и самой АВМ, в настоящее время применяется тактика ургентного ангиографического исследования у пациентов с внутричерепным кровоизлиянием сразу при поступлении в стационар. Противопоказанием могут являться лишь нарастающие нарушения витальных функций, дислокационный синдром, вынуждающие проводить либо реанимационные мероприятия или экстренное вмешательство, направленное на устранение сдавления мозга.При аллергии на препараты с рентгенконтрастными веществами, содержащими йод, рекомендуется проведение магнитно-резонансной ангиографии (МРА).
- Для решения вопроса о необходимости выполнения контрастного исследования сосудов головного мозга (КТА, ЦА) у пациентов с нетравматическими ВМГ, рекомендуется оценка кровоизлияния по шкале SICH (secondary intracerebral hemorrhage score), предложенную Almandoz J.E.D. с соавт. в 2010 году (см. Приложение Г12) [75].
- Комментарий: Факторами риска вторичного геморрагического инсульта являются: анатомическая форма кровоизлияния по данным нативной КТ, пожилой возраст пациента, женский пол, отсутствие артериальной гипертензии и нарушений коагуляции(см. приложение Г12). При оценке по шкале SICH в 0-2 балла вероятность сосудистой патологии составляет 3%, в 3 балла и более – 34%.
- Для клиник, выполняющих КТ-ангиографию не всем пациентам с нетравматическими внутримозговыми кровоизлияниями.
- SICH 0 – КТА и ЦА не показаны.
- SICH 1-2 –выполняют КТА и лишь при наличии сосудистой патологии или подозрении на нее проводят ЦА.
- SICH 3-6– выполняют ЦА без КТА
- Для клиник, в которых всем пациентам с ВМГ выполняют КТ-ангиографию.
- SICH 0-2 – ЦА проводят при наличии сосудистой патологии или подозрении на нее при КТА.
- SICH 3-6– всем пациентам проводят ЦА вне зависимости от наличия патологии при КТА.
- Ангиографически скрытые АВМ встречают в 22-30% [75]. Мальформации могут быть не обнаружены при ангиографии из-за небольших размеров и сдавления гематомой [76,77].
- При отсутствии АВМ при первичной ЦА целесообразно выполнение повторной ЦА после резорбции ВМГ для обнаружения мальформации.
- Ангиографическими факторами риска разрыва АВМ являются стеноз и варрикоз эфферентов, исключительно глубинное венозное дренирование, единственный эфферент, венозный рефлюкс,экстра-и интранидальные аневризмы [37, 78, 79, 80].
- Связанные с АВМ аневризмы образуются у 14% пациентов с АВМ [81]. При мальформациях больших полушарий аневризмы выявляют в 11%, при АВМ задней черепной ямки – в 30% [82]. Redekop G. с соавт. (1998) разделили все связанные с АВМ аневризмы на интранидальные, гемодинамически связанные (проксимальные и дистальные) и не связанные с мальформацией [83]. Экстранидальные проксимальные аневризмы встречаются в 68%,дистальные – в 32%, множественные – в 24% [81].При сочетании АВМ и аневризм аневризмы являются причиной кровоизлияния в 16%, АВМ – в 72%, в 12% невозможно установить источник кровоизлияния [84].Геморрагический тип течения характерен для 61% АВМ при наличии сочетанных аневризм и для 44% без них.При увеличении размера гемодинамически связанных аневризм, риск кровоизлияния повышается [85].
2.5 Иные диагностические исследования
- Рекомендуется всем пациентам с аСАК для оценки выраженности церебральноговазоспазма (ЦВ) проводить транскраниальную ультразвуковую допплерографию (ТКДГ) с измерением линейной скорости кровотока в М1 сегменте СМА и вычислением индекса Линдегаарда [14,86].
- Комментарии: Степени выраженности ЦВ представлена в таблице 3.
Таблица 3. Степени выраженности ЦВ на основании ТКДГ [31]
| Систолическая (средняя) скорость по СМА, см/сек | Индекс Линдегаарда (соотношение скоростейСМА/ВСА шея) | Интерпретация |
|---|---|---|
| 120 — 160 (100 — 120) | 2 — 3 | Легкий |
| 160 – 240 (120 – 200) | 3 — 6 | Умеренный |
| > 240 (200) | > 6 | Тяжелый |
3. Лечение
3.1 Лечение аневризматического САК
3.1.1. Хирургическое лечение
- Рекомендуется проведение операции на АГМ в остром периоде САК [15, 87, 88, 89, 90]:
- А. пациентам с тяжестью САК I— IV стадиями по Hunt-Hess независимо от срока после кровоизлияния.
- Б. пациентам с тяжестью САК V стадии по Hunt-Hess в течение первых суток после кровоизлияния и при оценке по ШКГ 8 баллов и более, при наличии ВМГ объемом 30 см3 и более.
- Не рекомендуется операции на аневризме в остром периоде САК у пациентов в крайне тяжелом состоянии (7 баллов по ШКГ и менее)[88-91, 226, 227]:
- Комментарии: в отдельных случаях решение о проведении операции у тяжелых пациентов принимается на основании расширенной врачебной комиссии.
- Рекомендуется при отсутствии противопоказаний проводить операции в течение 24 часов с момента диагностики разорвавшейся АГМ [15, 87, 88-90, 92].
- Комментарии: у пациентов со сложными аневризмами (гигантскими, фузиформными, вертебробазилярными) на предоперационную подготовку может потребоваться более длительное время.
Существуют 2 метода лечения АГМ – микрохирургический и эндоваскулярный.
- Рекомендуется проведение микрохирургической операции пациентам с аневризмами супраклиноидного отдела ВСА, перикаллезной артерии, ПСА, СМА, устья ЗНМА[12,14, 92, 93].
- Комментарий: При невозможности по каким-либо причинам провести микрохирургическую операцию, следует рассмотреть возможность проведения эндоваскулярной операции.
- Рекомендуется проведение эндоваскулярной операции пациентам с аневризмами супраклиноидного отдела ВСА, перикаллезной артерии, ПСА, СМА, устья ЗНМА, развилки и ствола базилярной артерии, офтальмического сегмента ВСА при технической возможности выключения аневризмы внутрисосудистым методом [12,14, 92, 93].
- Комментарий: При невозможности по каким-либо причинам провести эндоваскулярную операцию, следует рассмотреть возможность проведения микрохирургической операции
- Рекомендуется проводить выбор метода хирургического лечения пациентов с аневризматическим САК в состоянии Hunt-Hess I-III стадий на основании алгоритма представленного на рис. 2 (Приложение Б) [12].
- Рекомендуется проводить выбор метода хирургического лечения пациентов с аневризматическим САК в состоянии Hunt-Hess IV-V стадий на основании алгоритма представленного на рис. на рис. 3 (Приложение Б) [12].
- Рекомендуется первоочередное выключение разорвавшейся аневризмы наиболее приемлемым (микрохирургическим или эндовазальным) способом (рис. 3, Приложение Б). [12,14, 92]
- Комментарий: Возможность выключения всех аневризм из кровотока за одно хирургическое вмешательство или в несколько этапов, в том числе, с комбинацией микрохирургических и эндовазальных вмешательств, решается индивидуально в каждом конкретном случае.
- Рекомендуется микрохирургическое выключение аневризмы путем клипирования ее шейки или выключения несущей аневризму артерии у пациентов с аневризмами супраклиноидного отдела ВСА, перикаллезной артерии, ПСА, СМА, устья ЗНМА[14, 87, 92, 94].
- Комментарий: При выключении вместе с аневризмой несущей артерии решение о необходимости дополнительной реваскуляризирующей операции или вынужденной декомпрессивной трепанации черепа принимается оперирующим врачом в зависимости от конкретной ситуации.
- Рекомендуется широкая латеральная супраорбитальная краниотомия при типичных аневризмах передних отделов вилизиева круга или другой доступ в зависимости от локализации аневризмы (передний межполушарный, срединный субокципитальный, ретросигмовидный) [14, 87, 95].
- Рекомендуется после окончательного наложения клипсов вскрыть тело аневризмы [31, 95, 87].
- Комментарий: Отсутствие кровотечения будет свидетельствовать о полном выключении дна аневризмы
- Рекомендуется интраоперационный контроль проходимости несущих аневризму артерий и функционально значимых ветвей посредством визуальной оценки области клипирования (через микроскоп и/или эндоскоп), ультразвукового исследования кровотока в артериях головного мозга или с помощью флюоресцентной видеоангиографии [87, 92, 95, 96].
- Комментарий: в послеоперационном периоде после микрохирургического выключения аневризмы из кровотока для оценки состояния пришеечной части и подтверждения радикальности ее клипирования проводят контрольные ангиографические исследования (КТА или ЦА)[14, 87, 97].
- Рекомендуется окклюзия полости аневризмы микроспиралями или выключения несущей аневризму артерииу пациентов с аневризмами кавернозного отдела ВСА и офтальмического сегмента ВСА, основной артерии, задней мозговой артерии, ствола позвоночной артерии [14, 88, 93].
- Рекомендуется все эндоваскулярные операции по поводу АГМ в остром периоде проводить под наркозом [14, 98, 99].
- Рекомендуется тотальная окклюзия АГМ (Raymond-Roy 1) у пациентов в компенсированном (Hunt-Hess I-II) и субкомпенсированном состоянии (Hunt-Hess III) [14, 87, 88, 93]
- Рекомендуется субтотальная (Raymond-Roy 2) окклюзия разорвавшейся аневризмы у пациентов в тяжелом состоянии (Hunt-Hess IV-V) при невозможности тотальной окклюзии [87, 88]
- Комментарий: Повторную операцию с целью тотальной окклюзии аневризмы проводят в подостром или холодном периодах, после стабилизации состояния[14, 87].
- Рекомендуется первичная контрольная ЦА через 3-6 мес после операции для исключения реканализации аневризмы после ее тотальной окклюзии микроспиралями [14, 88].
- Рекомендуется НВД всем пациентам с острой гидроцефалией и при наличии показаний (контроль ВЧД, купирование ВЧГ) у других пациентов с САК [14, 100-102].
- Комментарий: НВД устанавливается из стандартной точки Кохера в контралатеральное по отношению к основному хирургическому доступу полушарие. Желательно устанавливать НВД в одну операцию, как первый этап перед краниотомией и клипированием аневризмы.
- В случае эндоваскулярного вмешательства НВД устанавливают в операционной сразу после окклюзии аневризмы до пробуждения пациента после наркоза.
- Если при эндоваскулярной операции планируется стентирование и введение пациенту дезагрегантов, НВД следует устанавливать перед вмешательством после вводного наркоза.
- Рекомендуется установка двух дренажей с каждой стороны пациентам с выраженным ВЖК (10 – 12 баллов по шкале Graеb)[101, 103, 228].
Выделяют первичную (выполняется в ходе операции клипирования аневризмы) и вторичную (выполняется отсрочено) ДТЧ.
- Рекомендуется первичная ДТЧ пациентам в остром периоде САК при наличии одного из факторов: 1) Hunt-Hess V, 2) дислокация срединных структур более 5 мм, 3) внутримозговая гематома более 30 мл, 4) признаки острой ишемии у пациентов с массивным базальным САК (FisherIII) на 4-8 сутки после кровоизлияния [13, 104, 243].
- Рекомендуется вторичная ДТЧ при наличии признаков рефрактерной ВЧГ[12,104,105]
- Комментарий: Рефрактерной считается ВЧГ, которая не поддается коррекции при консервативной терапии, и ВЧД остается выше 20 мм рт.ст [106-110].
- Рекомендуется при проведении ДТЧ соблюдать следующие хирургические параметры [13, 104, 105, 111].:
- ДТЧ выполняется со стороны полушария с наиболее выраженным отеком.
- Оптимальной является лобно-теменно-височная краниоэктомия.
- Размеры ДТЧ должны быть 12-15 см в переднезаднем направлении.
- Обязательна резекция чешуи височной кости до основания средней черепной ямки.
- Важным условием ДТЧ является пластика твердой мозговой оболочки (ТМО) с увеличением подоболочечного пространства для отекающего мозга.
- Это достигается за счет вшивание фрагмента надкостницы или искусственных заменителей ТМО.
- Герметичное ушивание ТМО при ее пластике снижает риск послеоперационной ликвореи.
- В ходе операции желательно не вскрывать лобную пазуху и воздухоностные ячейки височной кости и обеспечить надежный этапный и окончательный гемостаз
- Рекомендовано мониторирование ВЧД всем пациентам после операции находящимся на продолженной мед. седации или в коме[87,106, 109, 110].
3.1.2. Анестезиологическое обеспечение операций в остром периоде аневризматического САК
- А. Анестезия и анальгезия пациента во время операции
- Б. Предотвращение повторного разрыва аневризмы на всех этапах операции до момента выключения аневризмы;
- В. Обеспечение релаксации мозга для облегчения хирургического вмешательства и уменьшения тракционного повреждения мозгового вещества.
- Г. Поддержание адекватной мозговой перфузии для профилактики ишемии мозга;
Рекомендации:
- Рекомендуется пероральная премедикация: производныебензодиазепинаи #клонидин 0,1-0,2мг (последний эффективен под язык и наряду с анксиолитическим эффектом снижает системное АД) [87, 98, 112, 117, 250]
- Комментарий: у пациентов в тяжелом состоянии (Hunt-Hess IV) премедикация применяется ограниченно для сохранения и контроля уровня сознания до момента интубации.
- Рекомендуется для индукции в/в седативное средство (#пропофол**0,5-1 мг/кг) и опиоидный наркотический анальгетик (#фентанил** 5-10 мкг/ кг) [113, 114].
- Комментарий: возможно непродолжительное снижение АД, но у большинства пациентов; данная комбинация позволяет эффективно блокировать прессорную реакцию на ларингоскопию и интубацию трахеи[113, 114].
- Рекомендуется: упациентов с выраженной гипертонией внутривенно вводить периферический вазодилататор (например, органические нитраты).Миорелаксация достигается в/в введением миорелаксантов и поддерживается в ходе всей операции под контролем мониторинга нейромышечной проводимости [14, 229].
- Рекомендуется закреплять интубационную трубку пластырем и избегать компрессии яремных вен на шее. [87, 107, 114].
- Рекомендуется установка центрального венозного катетерапри наличии следующих факторов [15, 113, 114]:
- Hunt-Hess III — V
- Признаки вазоспазма, вне зависимости от тяжести состояния по Hunt-Hess.
- Пациенты, оперированные в 1-3 сутки САК, вне зависимости от тяжести состояния по Hunt-Hess
- Рекомендуется всем пациентам для измерения часового диуреза установка мочевого катетера после индукции [87, 114].
- Рекомендуется лок-регионарная анестезия скальпа (по линии кожного разреза, в местах установки шипов фиксирующей скобы и в проекции крупных чувствительных корешков) с помощью длительно действующих местных анестетиков [87, 95, 113].
- Рекомендуются в/ввведение гиперосмолярных препаратов (15% #Маннитол**в дозе 500мл или 1г/кг)[95, 115, 116].
- Комментарий: предпочтительно вводить препараты в центральную вену, с высоким темпом (в течение 10 – 15 мин). Инфузию следует начинать в момент кожного разреза.
- Рекомендуется пролонгирование анестезии с помощью непрерывного внутривенного введения пропофола** через инфузомат (около 100 мкг/кг/мин) и болюсного введения #фентанила** 2 мкг/кг/ч. [87, 117, 251, 252].
- Комментарий: Глубина анестезии на хирургической стадии наркоза в случае применения BIS-мониторинга поддерживается на уровне 30 ед [118].В случае необходимости проводится комплекс мер по защите мозга: доза пропофола** увеличивается до BIS < 20 ед. или до возникновения на ЭЭГ феномена «вспышка-подавление» (до 150 мкг/кг/мин + дополнительные болюсы пропофола** по 50 мг).Высокие дозы пропофола** могут задержать пробуждение.
- При операциях по поводу церебральной аневризмы рекомендуется проведение ИВЛ с учетом нормовентиляции (PaCO2 = 33-35 мм рт.ст.) [87, 95, 113, 114].
- Комментарий: Важно учитывать, что при нарушенной ауторегуляции мозгового кровотока в условиях вазоспазма и других нарушениях у пациентов с тяжелым САК, даже незначительный подъем PaCO2 влечет за собой скачок ВЧД. По этой причине безвентялиционные периоды (при интубации или пробуждении) должны быть как можно короче.
- Рекомендуется поддержание эуволемия (Hct > 30%) в течение всей операции [95, 112, 113].
- Комментарий: Учитывая высокую частоту гиповолемии, может потребоваться форсированная инфузионно-трансфузионная терапия уже в начале операции.
- Рекомендуется при снижении АД инфузия норэпинефрина** для поддержания адекватного церебрального перфузионного давления [107, 112, 114].
- Комментарий: Особенно важно не допускать гипотонии на этапах временного клипирования артерий.
- Рекомендуется прекращение введения фентанила** на этапе зашивания кожи [113, 114].
- Рекомендуется прекращение использования пропофола** после снятия с головы фиксирующей скобы [99, 112, 117, 251].
- Рекомендуется пробуждение всех пациентов в остром периоде САК в отделении реанимации [15, 87, 92, 95].
- Рекомендуется раннее пробуждение и экстубация пациентам с Hunt-Hess I-II, у которых не было осложнений во время операции [87, 113].
3.1.3. Интенсивная терапия при САК
Задачами консервативного лечения пациентов с САК в предоперационном периоде являются стабилизация состояния пациентов, профилактика рецидива САК, профилактика и лечение сосудистого спазма и ишемии мозга.
- Рекомендуется следующие мероприятия [14, 15, 31, 92]:
- А. Постельный режим;
- Б. Анальгезия и седация при проведении всех манипуляций;
- В. Поддержание нормотермии;
- Г. Установка желудочного зонда пациентам, находящимся в состоянии оглушения, сопора или комы из-за угрозы возможной аспирации;
- Д. Установка мочевого катетера пациентам, находящимся в состоянии оглушения, сопора или комы;
- Е.Назначение слабительных средств.
- Рекомендуется назначение противоэпилептических препаратов только в случаях повторных эпилептических приступов [15, 92].
- Рекомендуется хирургическое выключение из АГМ из кровотока в качестве основной мерой профилактики повторных кровотечений [14, 15, 92].
- Рекомендуется применение аминокислот с антифибринолитическим эффектом(аминокапроновая кислота**, транексамовая кислота**) только в тех случаях, когда возможна задержка проведения операции на срок более 24 часов [12, 14, 15].
- Комментарий: Длительное (более 3 суток) применение антифибринолитических средств не рекомендуется, так как риск церебральных ишемических осложнений и гидроцефалии возрастает [15]
- Рекомендуется обеспечение SpO2 ≥ 92 с инсуфляция кислорода при необходимости [95, 107].
- Рекомендуется интубация трахеи и перевод пациента на ИВЛ при наличии дыхательной недостаточности [107, 125].
- Рекомендуется поддерживать уровень систолического артериального давления (САД) в пределах 110—150 мм рт. ст [14, 15, 31,92].
- Рекомендуется для купирования эпизодов артериальной гипертензии использовать #нимодипин**2мг/час (46мг/сутки) внутривенно, капельно с одновременным назначением пероральных гипотензивных препаратов (АТХ: антигипертензивные средства) [14, 15, 31, 119].
- Рекомендуется при возникновении артериальной гипотензии инфузия растворов, влияющих на водно-электролитный баланс(кристаллоидных препаратов) [15, 31, 107].
- Рекомендуется применение блокаторов кальциевых каналов: нимодипин** в таблетированной форме по 60 мг каждые 4 ч peros в течение 21 дня [119, 120].
- Комментарий: Препарат следует назначать до появления инструментальных или клинических признаков ЦВ, так как он применяется только как профилактическое средство. При уже имеющемся ЦВ препарат неэффективен.
Состояние пациента, оперированного на аневризме в остром периоде кровоизлияния, зависит прежде всего от предоперационного состояния, особенностей операции и развития послеоперационных осложнений (церебральных и соматических). Наиболее частыми церебральными причинами тяжелого послеоперационного течения являются прогрессирующий ЦВ, ишемия и отек мозга, развитие арезорбтивной гидроцефалии. Ведение и лечение пациентовпосле операции осуществляется по тем же основным принципам, что и до операции. Однако имеются особенности, которые необходимо учитывать.
- Рекомендуется поднятие головного конца кровати на 30°[15, 87, 107].
- Рекомендуется начинать нутритивную поддержку в течение 24 часов после операции [107].
- Рекомендуется профилактика пролежней для маломобильных пациентов (повороты пациентов в кровати, противопролежневый матрас, гигиена) [107, 121].
- Рекомендуются компрессионные чулки или перемежающаяся пневмокомпрессия (у пациентов с выраженной варикозной болезнью) до момента активизации пациента. [15, 92, 122].
- Рекомендуется назначение препаратов группы гепарина через 2-24 часа после операции, при условии, что разорвавшаяся аневризма выключена и отсутствуют другие противопоказания [15, 123, 124].
- Рекомендуется исключение артериальной гипотонии на любом этапе лечения[14, 15].
- Рекомендуется обеспечение САД в интервале ± 20 мм рт ст от привычного для пациента уровня АД, но не ниже 100 мм рт ст.[15, 87, 92].
- Рекомендуется обеспечение SpO2 ≥ 92% с инсуфляцией кислорода при необходимости [95, 107].
- Рекомендуются целевые параметры для пациентовна ИВЛ: PaCO2 = 32-45 мм рт ст, РаО2 ≥ 80 мм рт ст, нормальный уровень рН [107, 125].
- Рекомендуется ранее выполнении трахеостомии при прогнозируемой длительной ИВЛ (седация/ ШКГ ≤ 8 баллов) [107, 125].
- Рекомендуется контролировать адекватное функционирование НВД[102, 126, 127].
- Рекомендуется следить за герметичностью и стерильностью дренажной системы[127, 128].
- Не рекомендуется гипердренирование ликвора: верхняя точка дренажной трубки должна быть на 10-15 см выше наружного слухового прохода.[102, 126, 128].
- Рекомендуется перекрывать НВД во время любых позиционных изменений, транспортировки и т.д. [87, 102, 128].
- Не рекомендуется проводить профилактических введений антисептиков и дезинфицирующих средств, антибактериальных препаратов системного действия в НВД[127, 128, 230].
- Рекомендуется всем пациентам с НВД проводить исследования ликвора (микробиологическое (культуральное) исследование спинномозговой жидкости на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы, исследование уровня глюкозы в спинномозговой жидкости, общий (клинический) анализ спинномозговой жидкости) не реже 1 раза в 3 дня или при наличии клинических показаний (гипертермия, лейкоцитоз, ликворея и др) [126, 128].
- Рекомендуется произвести одномоментное (без предварительного перекрытия на сутки) удаление НВД с герметичным ушиванием раневого канала[102, 128].
- Рекомендуется пациентам с аневризматическим САКТКДГ не реже одного раза в сутки [15, 87, 129].
- Рекомендуется динамическое наблюдение без гемодинамической терапии ЦВ при показателях ЛСК в М1 сегменте СМА < 240 см/сек, и/или индексе Линдегаарда < 5 [87, 129, 130].
- Рекомендуется проведение гемодинамической терапии ЦВ при показателях ЛСК в М1 сегменте СМА 240 см/сек и более, и/или индексе Линдегаарда 5 и более[87, 129, 130].
- Комментарий. Особенности гемодинамической терапии см. далее.
- Рекомендуется дифференциальная диагностика причин ухудшения состояния[15, 87, 131].
- Комментарий. Дифференциальная диагностика проводиться на основании:
- а. Клинической картины.
- Признаки клинически значимого ЦВ — прогрессирующее угнетение сознания, психомоторное возбуждение, появление нового неврологического дефицита, не наблюдавшегося после пробуждения пациента.
- б. КТ головы.
- В пользу ЦВ будет появление очагов ишемии. Также исключаются другие причины ухудшения: интракраниальная гематома, гидроцефалия и др.
- в. Внеплановой ТКДГ
- а. Клинической картины.
- Комментарий. Дифференциальная диагностика проводиться на основании:
- Рекомендуется проведение гемодинамической терапии ЦВ, который явился причинойухудшения состояния пациента [15, 87, 107].
- Рекомендуется ТКДГ не реже одного раза в сутки [15, 87, 130].
- Рекомендуется внеплановая ТКДГ при появлении признаков, указывающих на нарастание ЦВ [15, 129, 130].
- Комментарий: косвенными признаками, указывающими на нарастание ЦВ у пациентав бессознательном состоянии,являются повышение ВЧД, подъем САД, повышенный темп диуреза, снижение уровня натрия крови.
- Рекомендуется пациентам с ЦВ поддержание эуволемии за счет использования растворов электролитов (изотонических растворов) в объеме 500-1000 мл в сутки [14, 15, 107].
- Рекомендуется при снижении альбумина крови менее 30 г/л назначение альбумина человека** 25% из расчета на кг массы тела [87, 107].
- Рекомендуется пациентам с ЦВ поддержание умеренной артериальной гипертензии [14, 132, 133].
- Комментарий. Исходно САД повышается на 20-30 мм рт ст от исходного уровня, в дальнейшем – в зависимости от клинической ситуации. Возможные диапазоны САД — 150 – 200 мм рт ст, среднего АД — 90-120 мм рт ст (не выше 135 мм рт ст).
- Рекомендуется применение адренергических и дофаминергических средств для повышения АД [15, 132, 133].
- Рекомендуется пациентам с ЦВ норэпинефрин**на старте вазопрессорной поддержки [15, 132, 133].
- Рекомендуется использование добутамина** при сниженной сократительной способности миокарда [15, 132, 133].
- Рекомендуется у пациентов в сознании поддержание церебрального перфузионного давления (ЦПД) на минимальных значениях, при которых происходит улучшение неврологического статуса [87, 107, 132].
- Комментарий. ЦПД поддерживается за счет повышения АД и снижения повышенного ВЧД.
- Рекомендуется у пациентов без сознания поддержание ЦПД не ниже 60 мм рт ст [106, 107].
- У пациентов с нарушением бодрствования при выраженном кровоизлиянии (Fisher 3-4) рекомендуется измерение ВЧД через наружный вентрикулярный дренаж (НВД) или с помощью паренхиматозного датчика ВЧД [87, 92, 106].
- У пациентов, которым предполагается измерение ВЧД паренхиматозным датчиком, рекомендуется его имплантация на глубину 2-2,5 смв вещество интактного (противоположного по отношению к АГМ и хирургическому доступу) полушария головного мозга [87,106, 134].
- Не рекомендуется постоянный мониторинг ВЧД у пациентов после операции, находящихся в сознании и доступныхконтакту [106, 110, 134].
- Рекомендуется установка датчика ВЧД пациентам в коме или на продолженной медикаментозной седации[106, 110, 134].
- Рекомендуется начинать терапию внутричерепной гипертензии (ВЧГ) при ВЧД более 20 мм рт ст. [106, 107, 110].
- Комментарий. При неглубокой седации или у пациентов, приходящих в сознание, возможны кратковременные подъемы ВЧД до 25-30 мм рт. ст. (при мышечном напряжении, кашле, физиологических оправлениях и др.) не требующие специальной коррекции.
- Рекомендуется прекращение мониторинга ВЧД через 24 часа с момента нормализации ВЧД и прекращения интенсивной терапии, направленной на коррекцию ВЧГ [106, 134].
- Рекомендуется возвышенное на 30 — 40° положение головного конца кровати [15, 107].
- Рекомендуется у пациентов с НВД и повышением ВЧД выведение ликвора по НВД [14, 126, 128].
- Рекомендуются у пациентов с некупируемым повышением ВЧД проведение седации, миорелаксации и аналгезии [106, 107].
- Рекомендуется у пациентов с ЦВ поддержание ЦПД ≥ 70 мм рт. ст.[106, 107].
- Комментарий. Поддержание ЦПД обеспечивается повышением САД за счет инфузионной терапии и применения адренергических и дофаминергических средств;
- Рекомендуется у пациентов с повышением ВЧД проведение осмотерапии [106, 107, 110].
- Комментарий. Особенности проведения осмотерапии см. далее.
- Рекомендуется у пациентов с повышением ВЧД умеренная кратковременная гипервентиляция до уровня РаСО2 30-33 мм рт.ст.[106,110].
Осмотерапия – лечение с использованием гиперосмолярных растворов, к которым относятся 15% раствор #маннитола**и другие растворы с осмодиуретическим действием. Особенности проведения осмотерапии см. ранее.
- Рекомендуется проведение осмотерапии при повышении ВЧД > 20 мм рт. ст.[106, 110, 134]
- Не рекомендуется осмотерапия при гипернатриемия (> 160 ммоль/л) и осмолярности плазмы выше 320 мосмоль/л [106, 135]
- Рекомендуется инфузия 15% раствора #маннитола**из расчёта 1,0 г/кгв периферическую или центральную вену с относительно высокой скоростью, в течение 10-15 минут [106, 107, 110]
- Комментарий. Следует помнить, что длительное использование #маннитола** повышает риск водно-электролитных нарушений, гиповолемии и повреждения почек (канальцевый некроз).
- Рекомендуется при проведении осмотерапии контролировать гемодинамику, волемический статус, темп диуреза, и регулярно оценивать уровни натрия крови и осмолярности плазмы крови[15, 106].
- Рекомендуется пациентам с ЦВ в качестве нормальных значений уровня натрия крови считать диапазон 135 — 146 ммоль/л[135, 136, 107].
- Комментарий. При наличии отека мозга и повышении ВЧД, допустимо повышение натрия до 155-160 ммоль/л. Более высокие значения строго не рекомендуются.
- Рекомендуется коррекция гипонатриемиипри уровне натрия крови ≤ 135 ммоль/л[107,135].
- Комментарий. Гипонатриемия ассоциирована с риском нарастания ЦВ
- Рекомендуется для коррекции гипонатриемии применение #флудрокортизона**0,1-0,2 мкг три раза в сутки и подсаливание воды: 2-3 г соли каждые 6-8 часов[15, 135, 136, 231, 232].
3.1.4. Оценка исходов лечения пациентов
- Рекомендуется у пациентов, перенесших САК, проводить оценку исходов лечения по шкале исходов Глазго или модифицированной шкале Ренкина (Приложение Г)в сроки не ранее 6 мес после САК [14, 31, 92, 137].
Комментарий. Более ранняя оценка (при выписке пациента или в другие выбранные сроки) возможна как промежуточный этап.
3.2 Лечение гипертензивного внутримозгового кровоизлияния.
3.2.1 Консервативное лечение
3.2.1.0 Основная информация
Вопросы лечения геморрагического инсульта являются сложными и не до конца решенными. Существующие опубликованные результаты клинических исследований не позволяют сделать однозначные выводы о превосходстве консервативного или нейрохирургического лечения в отношении функционального восстановления пациентов во время стационарного лечения или в дальнейшем на амбулаторном этапе. Результаты клинических исследований нейрохирургического лечения свидетельствуют о том, что оно позволяет у некоторых пациентов избежать летального исхода, но его положительное влияние на степень инвалидизации в дальнейшем однозначно не установлено. Результаты клинических исследований консервативных методов лечения также не являются полностью однозначными, что зачастую затрудняет их практическое применение.
При геморрагическом инсульте часто возникает повышение цифр артериального давления (АД), что связано с неблагоприятными исходами при данном заболевании. Безопасность и эффективность снижения цифр систолического АД (САД) в острейшем периоде заболевания была изучена в рандомизированных клинических исследованиях ATACH [138], INTERACT [139], INTERACT2 [140], ATACH-II, а также дополнительно в пулированном анализе данных пациентов исследований INTERACT2 и ATACH-II, включившем 3829 пациентов возраста от 19 до 99 лет, которым проводилось консервативное лечение заболевания [141].
- Рекомендуется в острейшем периоде подтвержденного геморрагического инсульта в первые 24 часа после госпитализации осторожное снижение цифр АД в условиях его непрерывного мониторирования. У пациентов с исходным уровнем САД 150-220 мм рт. ст. безопасной является коррекция цифр САД до уровня 140 мм рт. ст., при этом следует стремиться к минимальной вариабельности цифр АД в течение первых 24 часов после госпитализации [141].
- Комментарии: результаты объединённого анализа INTERACT2 и ATACH-II показали, что снижение цифр АД было линейно связано с повышением вероятности более благоприятного 90-дневного исхода заболевания (оценка по модифицированной шкале Рэнкина 0-2 балла). У пациентов с цифрами САД более 220 мм рт. ст. может быть обоснованным более активное снижение цифр АД [141,142].
- Не рекомендуется в течение первого часа снижение цифр САД более, чем на 60 мм рт. ст. [141].
- Комментарии: в объединённом анализе INTERACT2 и ATACH-II снижение цифр САД более, чем на 60 мм рт. ст., было связано с повышением вероятности развития неблагоприятных 90-дневных исходов (оценка по модифицированной шкале Рэнкин 3 и более баллов (Приложение Г)).
В настоящее время в связи с все более активным применением антикоагулянтной терапии, в частности, для профилактики ишемического инсульта, увеличивается число геморрагических инсультов, возникших на фоне приема данных препаратов. Кроме того, геморрагический инсульт может возникать и на фоне антиагрегантной терапии, а также у пациентов с имеющимися заболеваниями системы гемостаза.
- Рекомендуется у пациентов с острейшим геморрагическим инсультом при повышенном МНО на фоне приема непрямых антикоагулянтов (АТХ антагонистов витамина K) их отмена и назначение препаратов группы витамина К (менадиона натрия бисульфит**), факторов свертывания крови II, VII, IX и X в комбинации (протромбиновый комплекс)** или свежезамороженной плазмы [142,143].
- Комментарии: в сравнении со свежезамороженной плазмой у факторов свертывания крови II, VII, IX и X в комбинации(протромбинового комплекса)** может возникать меньше осложнений, при их назначении возможна более быстрая коррекция МНО [142,143].
- Не рекомендуется у пациентов с острейшим геморрагическим инсультом применять фактор свертывания крови VII** для коррекции цифр МНО, увеличенных на фоне приема непрямых антикоагулянтов (АТХ антагонистов витамина K) [142].
- Комментарии: назначение фактора свертывания крови VII** может приводить к снижению МНО, но не замещает все необходимые факторы свертывания.
- Рекомендуется у пациентов с острейшим геморрагическим инсультом, получающих дабигатрана этексилат**, ривароксабан**, апиксабан**, их отмена и назначение на индивидуальной основе с учетом имеющихся показаний и противопоказаний антиингибиторного коагулянтного комплекса**, факторов свертывания крови II, VII, IX и X в комбинации (протромбиновый комплекс)** или фактора свертывания крови VII**[142].
- Комментарии: в настоящее время при геморрагическом инсульте изучаются другие антидоты антикоагулянтов (АТХ Антитромботические средства), но в настоящее время их возможный положительный эффект в условиях геморрагического инсульта не установлен.
- Рекомендуется для ингибирования эффекта гепарина натрия** у пациентов с острейшим геморрагическим инсультом на индивидуальной основе с учетом имеющихся показаний и противопоказаний назначение протамина сульфата** [142].
- Не рекомендуется у пациентов с геморрагическим инсультом, получавших препараты группы «антиагреганты, кроме гепарина», проводить трансфузию тромбоцитарной массы с целью ингибирования эффекта этих препаратов[142].
- Комментарии: возможный положительный эффект трансфузии тромбоцитарной массы при геморрагическом инсульте не установлен.
- Не рекомендуется назначение фактора свертывания крови VII**пациентам с геморрагическим инсультом без нарушения свертывания крови в связи с повышением риска тромбоэмболических осложнений [144,145].
3.2.1.1 Профилактика тромбоэмболических осложнений при геморрагическом инсульте.
Одним из важных факторов, влияющих на течение острого периода ГИ, является риск развития тромбоза глубоких вен нижних конечностей и тромбоэмболических осложнений (ТЭО), который является особенно высоким у пациентов с выраженными двигательными нарушениями или не являющихся мобильными вследствие иных причин. Особую сложность представляет профилактика ТЭО при ГИ, что требует оценки не только непосредственно риска ТЭО, но и риска повторного кровотечения.
- Рекомендуется у пациентов с геморрагическим инсультом, которые имеют риск развития ТЭО, профилактика тромбоза глубоких вен нижних конечностей, начиная со дня поступления методом переменной пневмокомпрессии [148, 149,150, 122] при отсутствии противопоказаний для ее применения.
- Комментарии: применение только эластической компрессии нижних конечностей не уменьшает риски тромбоза глубоких вен нижних конечностей и не улучшает исходы заболевания [148-150, 122]. Перед началом переменной пневмокомпрессии обоснованным является проведение дуплексного сканирования вен нижних конечностейдля исключения уже имеющегося тромбоза глубоких вен нижних конечностей.
- Рекомендуется у пациентов с геморрагическим инсультом, имеющим риск ТЭО, с целью профилактики ТЭО назначение препаратов группы гепарина в малых дозах при документальном подтверждении прекращения дальнейшего кровотечения в области гематомы [123].
- Комментарии: согласно данным метаанализа, включившего 1000 пациентов ГИ из 4 исследований, рандомизированными из которых были 2 [123], раннее применение препаратов эноксапарина натрия** или гепарина натрия** (спустя 1-6 дней после поступления) было связано со статистически значимым снижением частоты тромбоэмболии легочной артерии и незначительным увеличением объема гематомы.
- Рекомендуется при тромбозе глубоких вен нижних конечностей и/или тромбоэмболии легочной артерии в случае неэффективности иных методов профилактики/лечения ТЭО с учетом индивидуальных показаний и противопоказаний проведение внутривенной антикоагулянтной терапии препаратами группы гепарина, постановка кава-фильтра***или пликация нижней полой вены [123, 234, 235].
- Комментарии: решение о выборе данных методов лечения должно основываться на соотношении потенциальной пользы и риска, времени от возникновения инсульта, стабильности гематомы и общем состоянии пациента.
3.2.1.2 Возобновление приема антитромботических средств после геморрагического инсульта.
У пациентов, перенесших ГИ, получавших антиагрегантную/антикоагулянтную терапию по поводу других заболеваний или для профилактики сердечно-сосудистой, цереброваскулярной патологии и имеющих показания для назначения соответствующей терапии, следует рассматривать в качестве кандидатов для возобновления соответствующей терапии.
- Рекомендуется возобновление приема ацетилсалициловой кислоты**, дипиридамола, клопидогрела** в монотерапии или комбинации ацетилсалициловой кислоты** с дипиридамолом или клопидогрелом** у пациентов, перенесших геморрагический инсульт, которые до геморрагического инсульта принимали эти препараты при сохранении показаний к приему этих препаратов [151]. Срок возобновления должен определяться индивидуально в каждом случае [151].
- Комментарии: существующих данных [151] недостаточно, чтобы однозначно определить оптимальные сроки возобновления антиагрегантной терапии. При их приеме риск возникновения повторных кровоизлияний был значительно меньше, чем положительный эффект от вторичной профилактики острых нарушений мозгового кровообращения.
- Рекомендуется у пациентов, перенесших геморрагический инсульт и имеющих в долгосрочной перспективе очень высокий риск ТЭО, проводить возобновление приема антитромботических средств (антагонистов витамина К, прямых ингибиторов тромбина, прямых ингибиторов фактора Ха) на индивидуальной основе с учетом оценки потенциальной пользы и риска повторного кровотечения [119, 236-239].
- Комментарии: оптимальные сроки возобновления приема антитромбических средств неизвестны. В настоящее время проводятся клинические исследования, направленные на установление групп пациентов, у которых будет возможно возобновление приема антитромбических средств. В некоторых индивидуальных случаях фибрилляции предсердий для профилактики ТЭО более безопасной может быть имплантация окклюдера в ушко левого предсердия.
3.2.1.3 Коррекция отека мозга и повышенного внутричерепного давления при геморрагическом инсульте.
На течение острого геморрагического инсульта значимое влияние оказывает формирование отека мозга, которое может также сопровождаться и повышением ВЧД. Это требует принятия мер по их коррекции.
- Рекомендуется у пациентов с геморрагическим инсультом при объеме гематомы ≥15 мл, наличии признаков повышения ВЧД и отека мозга назначение маннитола** на индивидуальной основе с учетом имеющихся показаний и противопоказаний [146, 233].
- Комментарии: влияние маннитола** изучено в субанализе когорты пациентов INTERACT2, включившей 2839 пациентов [146]. Его назначение было безопасным, и частота возникновения нежелательных явлений в подгруппе пациентов, получавших маннитол**, не превышала их частоту у пациентов, не получавших маннитол**.
- Не рекомендуется назначение дексаметазона** при геморрагическом инсульте в связи отсутствием доказанного эффекта и повышением риска летального исхода [147].
3.2.2. Хирургическое лечение ГИ
3.2.2.0 Основная информация
Хирургическое лечение направлено на устранение компрессии, дислокации мозга, окклюзионной гидроцефалии, что приводит к достоверному снижению летальности, а у части пациентов, у которых консервативное лечение неэффективно, и к уменьшению неврологического дефицита уже в остром периоде заболевания [152-156].
Для выполнения хирургических вмешательств в операционной необходимо иметь микроскоп и набор микрохирургических инструментов для проведения сосудистых нейрохирургических операций, нейроэндоскопическое оборудование и инструменты, навигационную станцию.
Минимально инвазивные операции (пункционная аспирация и локальный фибринолиз, эндоскопическая аспирация) могут быть выполнены мод локо-регионарной анестезией.
Факторами риска неблагоприятного исхода при хирургическом лечении являются [1,157, 158]:
- снижение бодрствования до сопора и ниже;
- объем внутримозговой гематомы более 50 см3;
- массивное вентрикулярное кровоизлияние;
- поперечная дислокация 10 мм и более;
- деформация цистерн ствола мозга;
- рецидив кровоизлияния.
Хирургическое вмешательство производят сразу после обследования и определения типа гематомы [153,156,159]. При компенсированном состоянии пациента, нормальном бодрствовании или его снижении не глубже оглушения, отсутствии признаков нарастания компрессии мозга, но высоких цифрах артериального давления (систолическое более 200 мм рт. ст.) во избежание трудностей с интраоперационным гемостазом и послеоперационного рецидива гематомы операцию целесообразно отложить до снижения и стабилизации АД. В ряде случаев на протяжении первых суток гематома может продолжать формироваться и склонна к рецидивам, поэтому проведение хирургического удаления гематом в первые 24 часа связано с повышенным риском рецидива кровоизлияния [160, 161, 162].
- Рекомендуется удаление путаменальных и субкортикальных гематом объемом более 30 см3, вызывающих выраженный неврологический дефицит и/или дислокацию мозга (смещению срединных структур более 5 мм или деформации цистерн ствола мозга) [1,157].
- Рекомендуется удаление гематомы мозжечка объемом более 10-15 см3, диаметром более 3 см, вызывающей компрессию ствола мозга и/или окклюзионную гидроцефалию [1,157].
- Рекомендуется хирургическое лечение при кровоизлиянии в таламус, сопровождающимся гемотампонадой желудочков и/или окклюзионной гидроцефалией [1,70].
- Комментарий. Целесообразность хирургического удаления гипертензивных гематом таламуса объемом более 10 см3 и ствола, сопровождающихся грубым неврологическим дефицитом, обсуждается, и устоявшегося мнения на этот счет среди нейрохирургов пока нет [154].
- Не рекомендуется хирургическое вмешательство при угнетении бодрствования до комы (ШКГ — 7 баллов и менее) [1,157].
- Не рекомендуется проведение операции на фоне выраженной артериальной гипертензии (систолическом АД более 200 мм рт.ст.) [142, 162].
- Комментарий. Относительным противопоказанием к операции является наличие тяжелой соматической патологии (сахарный диабет, почечная, печеночная, сердечно-сосудистая и легочная патология в стадии суб- и декомпенсации, коагулопатии, сепсис) [1].
3.2.2.1 Методы хирургического лечения
- Рекомендуется миниинвазивное удаление путаменальных и мозжечковых гематом (с использованием метода стереотаксиса, эндоскопии, локального фибринолиза) в случае отсутствия выраженного дислокационного синдрома, угрожающей жизни дислокации головного мозга по данным КТ. Операция может быть дополнена локальным фибринолизом [1,157].
- Рекомендуется открытое удаление субкортикальных гематом, а также гематом путаменальной и мозжечковой локализации с клиникой быстрого нарастания дислокационного синдрома [163].
- Комментарии. При субкортикальных кровоизлияниях необходима микрохирургическая ревизия полости гематомы для удаления возможной ангиографически негативной мальформации, частота встречаемости которых может достигать 30%. При путаменальном и мозжечковом кровоизлиянии открытая операция преследует цель быстрого создания наружной декомпрессии мозга и предупреждения или устранения нарастающей компрессии и дислокации мозга [163,164].
- Не рекомендуется выполнять только наружное вентрикулярное дренирование без удаления гематомы мозжечка ввиду возможного увеличения аксиальной дислокации мозга [1,157,162,165].
- Рекомендуется удаление субкортикальных гематом одним из миниинвазивных методов (с использованием метода стереотаксиса, эндоскопии, локального фибринолиза), если у пациента имеется тяжелая соматическая патология, но только после проведения церебральной ангиографии и исключения сосудистой мальформации [1].
- При небольших гематомах мозжечка, сопровождающихся смещением и/или окклюзией IV желудочка или сильвиева водопровода и развитием окклюзионной гидроцефалии, рекомендуется проведение наружного дренирования желудочков, либо эндоскопической тривентрикулостомии [1,166].
- Рекомендуется у пациентов с гидроцефалией проводить наружное дренирование до регресса окклюзионной гидроцефалии и восстановления проходимости желудочковой системы [1,166].
- При массивном кровоизлиянии в боковые желудочки возможно их наружное дренирование с проведением локального фибринолиза сгустков крови или их эндоскопическое удаление (при условии исключения сосудистой аномалии) [157,167].
- При тяжелом состоянии пациента (снижение бодрствования до глубокого оглушения и сопора, выраженная соматическая патология), которое может потребовать длительной интенсивной терапии в послеоперационном периоде, вмешательство на гематоме рекомендовано дополнять установкой датчика измерения внутричерепного давления [1].
- Рекомендуется при удалении путаменальных, мозжечковых, вентрикулярных кровоизлияний проведение пункционной аспирации гематомы с использованием нейронавигации [38, 103, 165-170].
- Рекомендуется после интраоперационной аспирации кровипри путаменальных, мозжечковых, вентрикулярных гематомахпроводить локальный фибринолиз оставшихся сгустков крови [38, 103, 165-170, 240].
- Комментарий. При фибринолизе для однократного введения используют 5000-60000 МЕ #урокиназы, 50-100 тыс. МЕ #проурокиназы** [103, 240]. Введение антифибринолитических средств и аспирацию лизированной крови осуществляют каждые 6-12 часов в зависимости от вида препарата. Оптимальное время дренирования гематомы без увеличения риска инфекционных осложнений, связанных с наличием дренажа и интратекальным введением препарата — 24-72 часа.Ни один из препаратов, используемых при локальном фибринолизе кровоизлияний, в Российской Федерации для интратекального введения не сертифицирован.
Алгоритм ведения пациентов с ГИ представлен на рис. 1 Приложения Б.
3.2.3. Послеоперационная терапия при ГИ
После операции пациент находится в отделении нейрореанимации.
- Рекомендуется проведение контрольной КТ головного мозга в течение 24 часов после операции. В период проведения фибринолиза рекомендуется выполнять КТ каждые 24 часа. После удаления дренажа рекомендуется проведение КТ на 7 и 21 сутки. При ухудшении (неврологическом) рекомендуется экстренно повторять КТ [103, 240]
- Для проведения ВЧД-ориентированной интенсивной терапии рекомендуется проведение мониторирования внутричерепного давления до его стойкой нормализации (менее 20 мм рт.ст.) [1, 142]
3.3 Лечение артериовенозных мальформаций
3.3.1 Хирургическое лечение
- При небольших размерах артериовенозной мальформации, ее компактном строении, доступной локализации и высоком риске повторного разрыва рекомендовано удаление и ВМГ, и АВМ [35].
- При АВМ большого размера, их размытом строении, труднодоступной локализации и дренировании в глубинную венозную систему рекомендовано изолированное удаление ВМГ без иссечения мальформации [35]
- Комментарий. Работ, посвященных удалению гематомы без иссечения АВМ, обнаружить не удалось. При разрыве АВМ больших полушарий и наличии ВМГ объемом более 30 мл целесообразно выполнение экстренной операции – удаления гематомы с возможным иссечением мальформации [171].
- При разрыве АВМ и развитии окклюзионной гидроцефалии рекомендовано выполнение экстренной операции – вентрикулостомии [172, 173].
- При кровоизлиянии из субтенториальной АВМ неотложная операция рекомендована при диаметре ВМГ более 3 см со сдавлением ствола мозга, ухудшением состояния пациента или появлении окклюзионной гидроцефалии [142].
- При разрыве АВМ и отсутствии угрожающих жизни ВМГ, гидроцефалии, а также гемодинамически связанных и интранидальных аневризм, хирургическое выключение мальформации из кровотока рекомендовано выполнять в отсроченном периоде, спустя 2-4 недели от кровоизлияния [174].
3.3.2 Эндоваскулярное лечение
- При АВМ размером более 3 см, наличии высокопоточных фистул и труднодоступном расположении перед резекцией мальформации рекомендовано выполнять ее предоперационную эмболизацию [175, 176, 177].
- Эмболизация АВМ перед радиохирургией рекомендована при больших размерах мальформации, наличии аневризм и артериовенозных фистул [178].
- При АВМ небольших размеров, ее фистулезном или однокомпартментном строении, небольшом количестве афферентов и их большом диметре в случае невозможности открытой операции рекомендовано выполнять тотальную эмболизацию мальформации [179, 180,181].
- При невозможности тотальной окклюзии АВМ, но наличии интранидальных аневризм, артериовенозных фистул и грубого синдрома “обкрадывания” рекомендовано выполнять паллиативную (заведомо частичную) эмболизацию гемодинамически слабых структур АВМ [182, 183].
- При разрыве АВМ и наличии гемодинамически связанных и интранидальных аневризм и венозных стриктур эмболизацию мальформации рекомендовано выполнять в первые несколько суток от разрыва [182,184].
- Для прогнозирования осложнений после эмболизации АВМ рекомендовано применять шкалу Buffaloscore (2015, см. приложение Г) [46].
- Для эмболизации плексиформных АВМ рекомендовано применять эмболизаты[183, 185, 186, 187]:
- — оникс 18
- — PHIL 25% и 30%
- — squid 12 и 18
- Для эмболизации фистулезных АВМ рекомендовано применять эмболизаты [183, 185, 186, 187]:
- — спирали
- — цианоакрилаты
- — оникс 36
- — PHIL 35%
- — катетеры с раздуваемым баллоном
- Трансвенозную эмболизацию АВМ вместо трансартериальной рекомендовано выполнять при малых размерах мальформации (менее 3 см), ее глубинной локализации, компактном ядре, единственной дренирующей вене, извитости и небольшом диаметре афферентов, исключительном кровоснабжение из перфорантных артерий и транзиторном тип кровоснабжения [188].
3.3.3 Радиохирургия
- Стереотаксическую радиохирургию АВМ рекомендовано выполнять при труднодоступной локализации мальформации или при наличии соматических заболеваний [77].
- Для радиохирургии АВМ рекомендовано применять гамма-нож (система радиотерапевтическая нейрохирургическая), линейный ускоритель или протонный пучок [178].
- Для однократного облучения АВМ при стереотаксической радиохирургии рекомендовано использовать дозу 16-25 Гр [189].
- При облучении АВМ размером более 3 см рекомендовано выполнять объемное стажирование [190]
- При неполной облитерации АВМ через 3 года после радиохирургии рекомендовано ее повторное облучение той же дозой (16-25 Гр) [178].
- При наличии гемодинамически связанных с АВМ аневризм и артериовенозных фистул облучение мальформации не рекомендуется [189].
- Облучение АВМ с разрывом рекомендовано выполнять через 6-12 недель после кровоизлияния [191].
- Для определения показаний к радиохирургии на гамма-ноже рекомендовано применяют шкалы RBAS (2002 и 2008, см. приложение Г) и VRAS (2013, см. приложение Г) [42, 49, 148].
- Для определения показаний к радиохирургии на линейном ускорителе рекомендовано применяют шкалу Heidelberg score (2012, см. приложение Г) [192].
- Для определения показаний к радиохирургии на протонном пучке рекомендовано применяют шкалу PRAS (2014, см. приложение Г) [50].
3.3.4 Тактика хирургического лечения при отсутствии жизнеугрожающих ВМГ
- При отсутствии угрожающей жизни ВМГ и окклюзионной гидроцефалии для определения показаний к резекции АВМ рекомендовано применять классификации S-M (1986), Lawton (2003) и Lawton-Young (2010) (см. приложение Г10, Г11 и Г18) [40,41, 42].
- При АВМ 1-2 балла по S-M, имеющих компактное строение и расположенных вне высокозначимых функциональных зон головного мозга (первичный двигательный центр, подкорковые ядра и ствол мозга) рекомендована резекция [193, 194,195].
- При АВМ 1-2 балла по S-M, имеющих размытое строение и расположенных в высокозначимых функциональных зонах головного мозга (первичный двигательный центр, подкорковые ядра и ствол мозга) рекомендована радиохирургия [195,196, 241].
- При АВМ 3 балла по S-M и размере менее 3 см (тип S1V1E1) рекомендована резекция [197].
- При АВМ 3 балла по S-M размером от 3 до 6 см, расположенных вне значимых зон, рекомендована индивидуальная тактика лечения [197].
- При АВМ 3 балла по S-M размером от 3 до 6 см, расположенных в функционально значимых зонах, рекомендовано консервативное лечение [197].
- При АВМ 4-5 баллов по S-M чаще всего рекомендовано консервативное лечение [198].
- Выключение из кровотока АВМ 4-5 по S-M рекомендовано лишь при высоком риске повторного разрыва, фармакорезистентной эпилепсии и прогрессирующем неврологическом дефиците. Таким пациентам рекомендовано выполнять комбинированное лечение в многопрофильных центрах [198,199].
3.3.5 Послеоперационное ведение пациентов
- При небольших АВМ без разрыва и отсутствии хирургических осложнений рекомендовано экстубировать пациентов в операционной с последующей транспортировкой в отделение нейрореанимации [200].
- При мальформациях среднего и большого размера без кровоизлияния, а также при небольших АВМ с разрывом или возникновения интраоперационных осложнений рекомендовано продолжать медикаментозную седацию до выполнения контрольных КТ и ЦА или КТА [200].
- В послеоперационном периоде после резекции АВМ рекомендовано контролировать АД [201, 203].
- В послеоперационном периоде после выключения из кровотока АВМ 1-3 балла по S-M рекомендовано поддерживать систолическое АД менее 140 мм рт. ст. [202, 203].
- В послеоперационном периоде после окклюзии АВМ 4-5 баллов по S-M рекомендовано поддерживать среднее АД на уровне 70 мм рт. ст. и менее при перфузионном давлении более 50 мм рт. ст. [201].
- После резекции АВМ рекомендовано выполнять контрольную КТ головного мозга в течение суток от операции [203].
- После выявлении при послеоперационной КТ головного мозга угрожающей внутричерепной гематомы рекомендовано выполнение повторной операции – удаления гематомы [200].
- При выявлении при послеоперационной КТ значимого отека головного мозга рекомендовано проводить мероприятия по мониторингу и снижению ВЧД [200].
- Для исключения остаточной АВМ после ее резекции рекомендовано выполнять ЦА [77].
- При выявлении остаточной АВМ при послеоперационной ЦА рекомендовано выполнять дальнейшее ее выключение из кровотока при помощи резекции, эмболизации или радиохирургии [77, 195,200, 204, 205]
- После радиохирургии АВМ рекомендовано выполнять контрольные МРТ головного мозга каждые 6-12 месяцев [77, 178].
- После радиохирургии АВМ при ее тотальной облитерации по данным МРТ рекомендовано выполнить ЦА для подтверждения полноты окклюзии мальформации [77, 178].
4. Медицинская реабилитация и санаторно-курортное лечение
- Реабилитационные мероприятия рекомендовано проводить в соответствии с общими принципами реабилитации неврологических и нейрохирургических пациентов [206].
5. Профилактика и диспансерное наблюдение
- С целью профилактики развития мозговых сосудистых катастроф у пациентов с заболеваниями сердечно-сосудистой системы рекомендовано контролирование артериального давления, повышение физической активности, контролирование веса тела, правильное питание, отказ от курения [14, 207].
- Пациентам с выявленными пороками сосудов головного мозга (аневризма, артериовенозная мальформация) рекомендовано исследование сосудов головного мозга у родственников первой линии родства (КТ или МРТ головного мозга с ангиографией) для выявления сосудистой патологии [207, 208].
- Пациентам с сосудистыми заболеваниями головного мозга (аневризма, артериовенозная мальформация, перенесенное гипертензивное кровоизлияние) рекомендовано диспансерное наблюдение врачом-неврологом [208].
- После операции по поводу аневризмы головного мозга рекомендовано выполнение контрольных исследований (КТА или МРА головного мозга) через 6-12 месяцев после операции для исключения повторного заполнения аневризмы и новообразованных аневризм [208,209].
- Пациентам с АВМ независимо от проводимых лечебных мероприятий и их эффективности рекомендуется длительное диспансерное наблюдение [208,209].
- Комментарий. Целью наблюдения является выявление прогрессирования, рецидива заболевания, коррекции эпилептического синдрома. У пациентов, оперированных по поводу АВМ, в послеоперационном периоде возможно развитие повторного внутричерепного кровоизлияния. Наиболее частыми причинами этих осложнений являются: реканализация мальформаций, резидуальная часть мальформации, сопутствующая аневризма. Продолжительность диспансерного наблюдения: после эрадикации АВМ и отсутствии клинических проявлений — не менее 5 лет; во всех остальных случаях — пожизненно.
- Группы наблюдения:
- I. Пациенты с неоперабельными АВМ.
- II. Пациенты с резидуальными АВМ после вмешательств.
- III. Пациенты после эрадикации (удаления, тотальной облитерации) АВМ.
- IV. Пациенты после радиохирургического лечения АВМ.
- В большинстве случаев содержание диспансерного наблюдения ограничивается проведением коррекции эпилептиформного синдрома, контроля состояния АВМ.
- После радиохирургии рекомендуется:
- МРТ-МРА через 6 месяцев, затем ежегодно в течение 3 лет [248].
- селективная ангиография через 3 года после облучения для верификации облитерации АВМ. При отсутствии полной облитерации решается вопрос о повторной радиохирургии или микрохирургическом удалении АВМ [248].(
6. Организация оказания медицинской помощи
- Показания к госпитализации.
- Все пациенты с ОНМК подлежат госпитализации.
- Первичная госпитализация пациента с клинической картиной ОНМК должна экстренно осуществляться в первичное сосудистое отделение (ПСО), где имеются службы нейровизуализации (КТ и МРТ) и возможность проведения интенсивной терапии.
- После верификации ОНМК по геморрагическому типу необходима срочная консультация врача-нейрохирурга для решения вопроса о необходимости перевода пациента в нейрохирургический стационар.
- Пациент с любой формой ГИ (ВМГ, ВЖК, САК) должен быть переведен в Региональный сосудистый центр, где имеется нейрохирургическое отделение.
- Организация консультативной нейрохирургической помощи
- Оперативная круглосуточная консультативная помощь пациентам с ГИ (в том числе с САК) осуществляется выездными консультативными нейрохирургическими бригадами, сформированными на базе отделений по оказанию хирургической помощи пациентам с острой сосудистой патологией головного мозга (как правило, на базе многопрофильного стационара скорой медицинской помощи).
- При невозможности выездной консультации врача-нейрохирурга, показана телемедицинская консультация врача-нейрохирурга из медицинских стационаров, оказывающих специализированную помощь пациентам сСАК и другими формами ГИ. В ходе телемедицинской консультации возможно обсуждение плана обследования и тактики лечения пациента, а также согласование условий перевода пациента в другой стационар.
- Госпитализация пациентов с нетравматическим внутричерепным кровоизлиянием в нейрохирургический стационар
- Пациента с сосудистой нейрохирургической патологией и кровоизлиянием необходимо госпитализировать в стационары, где имеются:
- А. Нейрохирургическое отделение;
- Б. Специалисты, владеющие опытом прямых микрохирургических операций по поводу АГМ, АВМ, ГИ;
- В. Специалисты, владеющие опытом эндоваскулярного выключения АГМ и АВМ;
- Г. Специалисты, владеющие опытом минимально инвазивной хирургии ГИ;
- Д. Отделение лучевой диагностики, оснащенное аппаратурой для проведения КТ или МРТ,спиральной КТА, МРА.
- Е. Ангиографическая операционная дляпроведения церебральной ангиографии (ЦА) и выполнения эндоваскулярных операций;
- Ж. Операционная,оснащенная оборудованием для микрохирургии и минимально инвазивной нейрохирургии (операционный микроскоп, микрохирургический инструментарий, съемные и постоянныенемагнитные клипсы, прибор для интраоперационной контактной допплерографии, система для стереотаксической нейронавигации /планирования, эндовидеоскопический комплекс для выполнения нейрохирургических операций);
- З. Отделение нейрореанимации.
- Пациента с сосудистой нейрохирургической патологией и кровоизлиянием необходимо госпитализировать в стационары, где имеются:
- Перевод в неврологический стационар
- Перевод пациента из нейрохирургического в неврологический стационар для дальнейшего восстановительного лечения показан при удовлетворительном заживлении послеоперационной раны и отсутствии хирургических осложнений.
7. Дополнительная информация
Крупные медицинские стационары (национальные и федеральные нейрохирургические центры, областные, краевые и республиканские клинические больницы), оказывающие специализированную помощь пациентам с ГИ (в том числе с САК), на основании собственных научных исследований и практического опыта могут разрабатывать и утверждать на заседании врачебной комиссии (за подписью главврача) или заседании кафедры неврологии и нейрохирургии (за подписью заведующего кафедры) собственные («внутренние») протоколы лечения пациентов с САК.
«Внутренний» протокол лечения пациентов с ГИв рамках конкретного стационара может вносить дополнения, но не должен вступать в противоречие с основными положениями настоящих клинических рекомендаций.
Критерии оказания качества медицинской помощи
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
|---|---|---|---|
| 1 | Выполнено КТ или МРТ головного мозга в течение 2 часов после госпитализации пациента в стационар | В | 3 |
| 2 | Выполнена церебральная ангиография (при субарахноидальном кровоизлиянии при наличии артериовенозной мальформации) | В | 2 |
| 3 | Госпитализация в отделение интенсивной терапии и реанимации осуществлена при нарушении витальных функций. | В | 4 |
| 4. | Выполнено хирургическое вмешательство (при путаменальных и субкортикальных гематомах объемом более 30 см3, вызывающих выраженный неврологический дефицит и/или дислокацию мозга (смещению срединных структур более 5 мм или деформации цистерн ствола мозга) или гематоме мозжечка объемом более 10-15 см3 диаметром более 3 см, вызывающей компрессию ствола мозга и/или окклюзионную гидроцефалию, или кровоизлиянии в таламус, сопровождающемся гемотампонадой желудочков и/или окклюзионной гидроцефалией) | В | 4 |
| 5. | Выполнено хирургическое вмешательство в течение 24 часов с момента поступления (при аневризматическом субарахноидальном кровоизлиянии) | С | 4 |
| 6. | В стационаре, оснащенном эндоскопическим и стереотаксическим оборудованием, операция при путаменальной и мозжечковой гематоме выполнена миниинвазивным методом | С | 4 |
| 7. | Выполнена КТголовного мозга в течение 24 часов после операции | В | 3 |
Приложение А3. Справочные материалы
Одним из ключевых элементов патогенеза геморрагического инсульта является перифокальный отек головного мозга, важнейшим элементом которого является вазогенный отек вещества головного мозга, возникающий на фоне нарушения проницаемости гематоэнцефалического барьера при сохранном кровотоке в перифокальной области. С формированием отека головного мозга неразрывно связано также и повышение внутричерепного давления, также являющееся неблагоприятным фактором при геморрагическом инсульте. Консервативные подходы к лечению геморрагического инсульта направлены в том числе на коррекцию вазогенного компонента перифокального отека и повышенного внутричерепного давления.
Одним из препаратов, направленных на указанные патофизиологические механизмы, является осмотический диуретик маннитол**, введение которого приводит к повышению осмотического давления плазмы, за счет чего создаются предпосылки для перераспределения жидкости из тканей в сосудистое русло, в т.ч. и из вещества головного мозга. За счет этого воздействия возможно снижение внутричерепного давления и уменьшение выраженности вазогенного компонента перифокального отека. В настоящее время в инструкции к препарату маннитол** указано противопоказание «геморрагический инсульт». Внесение этого противопоказания в инструкцию к препарату было обусловлено опасениями, что на фоне отмены маннитола** будет развиваться «рикошетное» повышение внутричерепного давления и будет усиливаться перифокальный отек, которые приведут к неблагоприятным исходам заболевания. Последние данные о влиянии маннитола** были получены на обширной выборке пациентов INTERACT2, включившей 2839 пациентов [146]. Назначение маннитола** было безопасным для пациентов: частота возникновения нежелательных явлений в подгруппе пациентов, получавших маннитол**, не превышала их частоту у пациентов, не получавших маннитол**. Таким образом, противопоказание для применения маннитола** при геморрагическом инсульте можно считать не соответствующим современным данным о безопасности данного препарата.
Приложение Б. Алгоритмы действий врача
Рис. 1. Алгоритм ведения (диагностика и выбор метода хирургического лечения при геморрагическом инсульте)
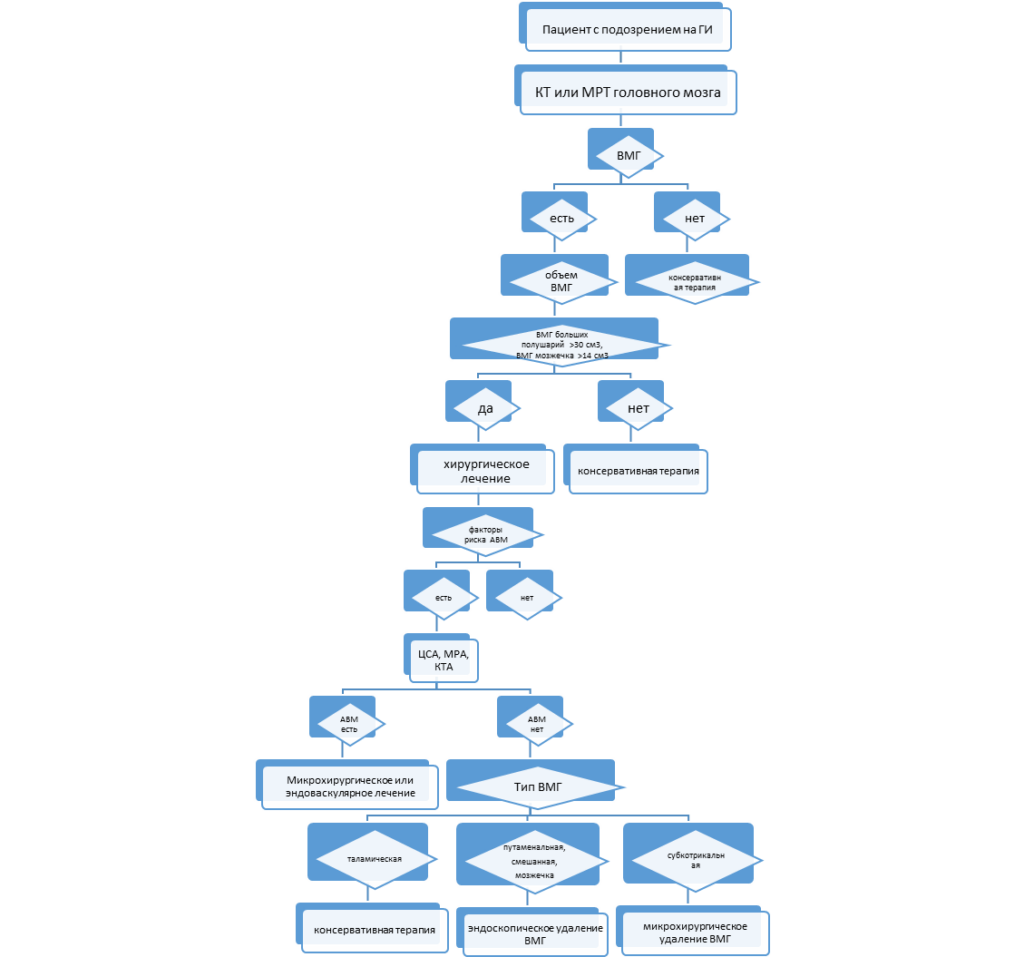
Рис. 2. Выбор метода хирургического лечения пациентов с аневризматическим САК в состоянии Hunt-Hess I-III.
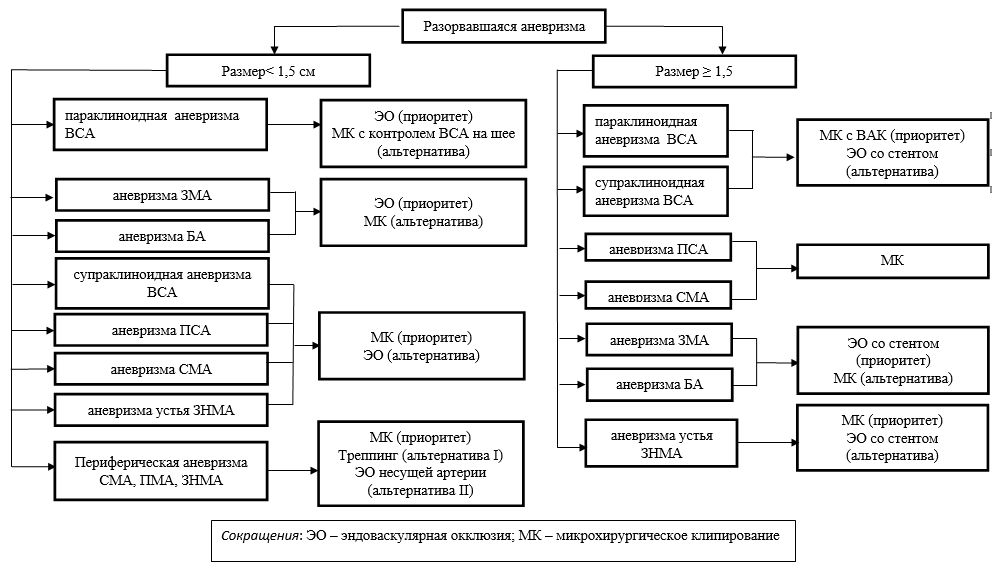
Рис. 3. Тактика лечения пациентов с аневризматическим САК в состоянии Hunt-Hess IV-V (кроме угнетения уровня сознания до умеренной комы и ниже).
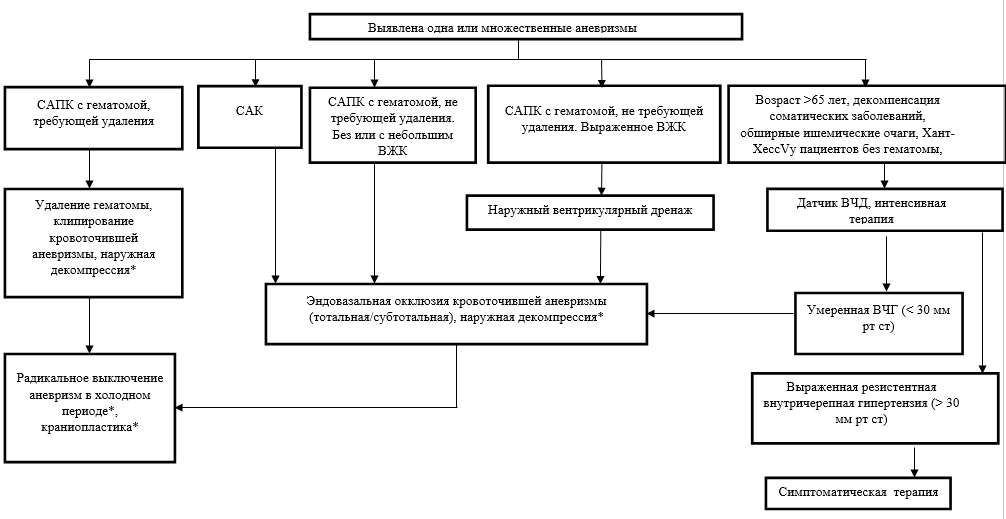
Рисунок 4. Алгоритм лечения АВМ
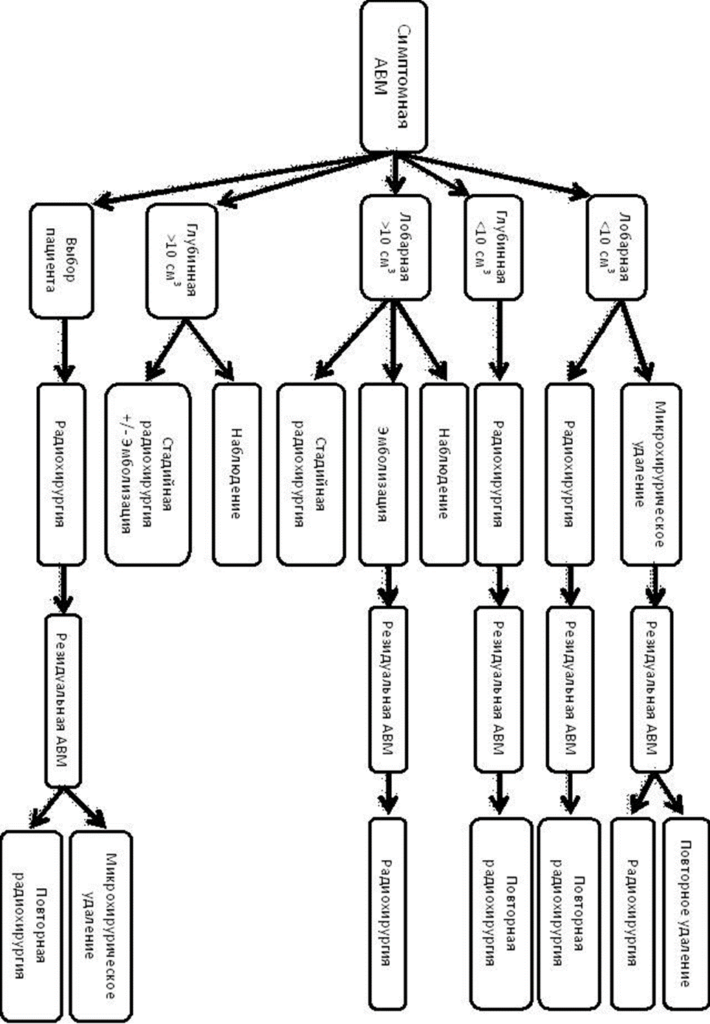
Приложение В. Информация для пациента
Наблюдение врача-невролога по месту жительства, контроль артериального давления,повышение физической активности, контроль веса тела, правильное питание, отказ от курения.
Приложение Г. Шкалы оценки, вопросники и др
Приложение Г1. Классификация Hunt-Hess.
- Название на русском языке: Классификация Hunt-Hess
- Оригинальное название (если есть): Classification of patients with intracranial aneurysms according to surgical risk
- Источник (официальный сайт разработчиков, публикация с валидацией): [8]
- Назначение: оценка хирургического риска в зависимости от времени вмешательства при пластике внутричерепных аневризм
Содержание (шаблон) и ключ (интерпретация):
| Стадия | Описание |
|---|---|
| I | Бессимптомное течение или легкая головная боль,небольшая ригидность затылочных мышц, парез ЧМН |
| II | Парез ЧМН (III пары) или головная боль от умеренной до сильной, ригидность затылочных мышц, парез ЧМН |
| III | Сонливость, спутанность сознания или легкая очаговая симптоматика |
| IV | Ступор, гемипарез от умеренного до сильного, начальные признаки децеребрации и вегетативных нарушений |
| V | Глубокая кома, децеребральная ригидность, агональное состояние |
*Серьезные системные заболевания и/или ангиоспазм, переводят пациента в нижележащую стадию.
Приложение Г2. Степень выраженности кровоизлияния по данным КТ на основании оригинальной и модифицированной шкалы Fisher
- Название на русском языке: шкала Fisher (оригинальная и модифицированная)
- Оригинальное название (если есть):Fisher scale,modified Fisher scale
- Источник (официальный сайт разработчиков, публикация с валидацией): [9-10]
- Назначение: оценка степени выраженности кровоизлияния по данным КТ
Содержание (шаблон) и ключ (интерпретация):
| Градация | Оригинальная шкала Fisher | Модифицированная шкала Fisher |
|---|---|---|
| 0 | — | Нет САК и ВЖК |
| 1 | Нет САК и ВЖК | САК, тонкий слой, нет ВЖК |
| 2 | САК, тонкий слой < 1 мм | САК, тонкий слой < 1 мм, есть ВЖК в обоих боковых желудочках |
| 3 | САК, толстый слой > 1 мм | САК, толстый слой > 1 мм, нет ВЖК |
| 4 | ВМГ или ВЖК | САК, толстый слой > 1 мм, есть ВЖК в обоих боковых желудочках |
Приложение Г3. Степень выраженности внутрижелудочковых кровоизлияний по Graеb D.A.
- Название на русском языке: Степень выраженности внутрижелудочковых кровоизлияний по Graеb D.A.
- Оригинальное название (если есть): нет
- Источник (официальный сайт разработчиков, публикация с валидацией): [11]
- Назначение: оценка степени выраженности внутрижелудочковых кровоизлияний
Содержание (шаблон) и ключ (интерпретация):
| Локализация | Количество баллов |
|---|---|
| Боковые желудочки (каждый желудочек считается отдельно) | 0 – нет крови |
| 1 – следы крови или незначительное кровоизлияние | |
| 2 — менее половины желудочка заполненокровью | |
| 3 — более половины желудочка заполнено кровью | |
| 4 — желудочек заполнен и растянут кровью | |
| Третий и четвертый желудочки | 0 – нет крови |
| 1 – Наличие крови, желудочек не увеличен | |
| 2 – Желудочек заполнен и растянут кровью | |
| Количество баллов | 0 — 12 |
Приложение Г4. Шкала комы Глазго [6]
- Название на русском языке: шкала комы Глазго
- Оригинальное название (если есть): Glasgow Coma Scale
- Источник (официальный сайт разработчиков, публикация с валидацией): [247]
- Назначение: оценка хирургического риска в зависимости от времени вмешательства при пластике внутричерепных аневризм
Содержание (шаблон):
| Баллы | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|
| Открывание глаз | Нет | Открывает на болевое раздражение | Открывает в ответ на голос | Открывает самопроизвольно, наблюдает | — | — |
| Речевая реакция | Никаких звуков | Издаёт звуки, но не слова | Произносит отдельные слова | Произносит фразы, но речь спутанная | Ориентирован, быстрый и правильный ответ на заданный вопрос | — |
| Двигательная реакция | Не двигается | Патологическое разгибание в ответ на боль (децеребрационная ригидность | Патологическое сгибание в ответ на боль (декортикационная ригидность) | Бессмысленные движения в ответ на боль | Локализует боль, пытается её избежать | Выполнение движений по голосовой команде |
Ключ (интерпретация):
| Баллы | Степени нарушения сознания |
|---|---|
| 15 | Ясное сознание |
| 13-14 | Умеренное оглушение |
| 10-12 | Глубокое оглушенние |
| 8 — 9 | Сопор |
| 6 — 7 | Кома умеренная |
| 4 — 5 | Кома глубокая |
| 3 | Кома запредельная |
Приложение Г5. Оценка тяжести состояния пациентов с САК по шкале WFNS
- Название на русском языке: Оценка субарахноидального кровоизлияния (САК) Всемирной федерации неврологических хирургов (WFNS)
- Оригинальное название (если есть): World Federation of Neurological Surgeons (WFNS) Subarachnoid Hemorrhage (SAH) Grading
- Источник (официальный сайт разработчиков, публикация с валидацией):[245]
- Назначение: Оценка тяжести состояния пациентов с субарахноидальным кровоизлиянием
Содержание (шаблон) и ключ (интерпретация):
- 0 степень САК по шкале WFNS: неразорвавшаяся аневризма.
- I степень САК по шкале WFNS: оценка по шкале комы Глазго 15 баллов, грубый неврологический дефицит (афазия, гемипарез/гемиплегия) отсутствует.
- II степень САК по шкале WFNS: оценка по шкале комы Глазго 13-14 баллов, грубый неврологический дефицит отсутствует.
- III степень САК по шкале WFNS: оценка по шкале комы Глазго 13-14 баллов, грубый неврологический дефицит присутствует.
- IV степень САК по шкале WFNS: оценка по шкале комы Глазго 7-12 баллов, грубый неврологический дефицит присутствует/отсутствует.
- V степень САК по шкале WFNS: оценка по шкале комы Глазго 3-6 баллов, грубый неврологический дефицит присутствует/отсутствует.
Приложение Г6. Шкала Hijdra для оценки интенсивности аневризматического САК
- Название на русском языке: Шкала Hijdra
- Оригинальное название (если есть): Hunt-Hess classification
- Источник (официальный сайт разработчиков, публикация с валидацией): [8]
- Назначение: оценка интенсивности аневризматического субарахноидального кровоизлияния
Содержание (шаблон) и ключ (интерпретация):
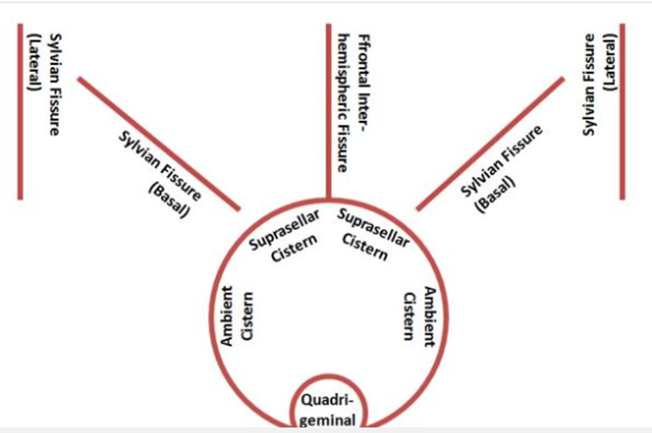
Оценка каждой из 10 базальных цистерн и щелей отдельно по шкале в соответствии с количеством крови:
- Нет крови = 0
- Малое количество = 1
- Умеренное количество = 2
- Полностью заполнена кровью = 3
Сгустки крови, которые превосходят истинные размеры цистерны или щели, оценивают как 3 балла
Расчет количества крови в субарахноидальном пространстве [сумма баллов]; вариабельность = 0 -30
Средний бал используют при неадекватной визуализируемой цистерне или щели
Оценка крови в четырех желудочках мозга
- Нет крови = 0
- Седиментация в нижней части желудочка = 1
- Частично заполнены = 2
- Полностью заполнены = 3
Расчет количества крови в желудочках мозга [сумма баллов]; вариабельность = 0-12
Приложение Г7. Классификация степеней выключения аневризм Raymond
- Название на русском языке: Классификация Raymond
- Оригинальное название (если есть): нет
- Источник (официальный сайт разработчиков, публикация с валидацией): [211]
- Назначение: оценка степеней выключения аневризм
Содержание (шаблон) и ключ (интерпретация):
- Raymond I – полная окклюзия аневризмы
- Raymond II – заполнение пришеечной части аневризмы
- Raymond III – остаточное заполнение аневризмы
Приложение Г8. Шкала прогнозов исхода внутримозгового кровоизлияния
- Название на русском языке: Шкала прогнозов исхода внутримозгового кровоизлияния
- Оригинальное название (если есть): The ICH score
- Источник (официальный сайт разработчиков, публикация с валидацией): [212]
- Назначение: оценка прогнозов исхода внутримозгового кровоизлияния
Содержание (шаблон):
| Показатель | Баллы |
|---|---|
| Шкала комы Глазго, баллы | |
| 3 – 4 | 2 |
| 5 – 12 | 1 |
| 13 – 15 | 0 |
| Объем ВМГ, см3 | |
| 30 или более | 1 |
| Менее 30 | 0 |
| Внутрижелудочковое кровоизлияние | |
| есть | 1 |
| нет | 0 |
| Субтенториальная локализация ВМГ | |
| да | 1 |
| нет | 0 |
| Возраст пациента, годы | |
| 80 и более | 1 |
| Менее 80 | 0 |
| Общее количество баллов | 0 – 6 |
Ключ (интерпретация): летальность зависит от количества баллов и составляет:
- при 0 баллов – 0,
- при 1 балле – 13%,
- при 2 баллах – 26%,
- при 3 баллах – 72%,
- при 4 баллах – 97%,
- при 5 – 6 баллах – 100%.
Приложение Г9. Модифицированная шкала Рэнкина
- Название на русском языке: шкала Рэнкина
- Оригинальное название (если есть): Rankin Scale
- Источник (официальный сайт разработчиков, публикация с валидацией): [246]
- Назначение: степени ограничения жизнедеятельности пациентов после перенесенного инсульта
Содержание (шаблон) и ключ (интерпретация):
| Балл | Описание состояния |
|---|---|
| 0 | Нет симптомов |
| 1 | Отсутствие значимых нарушений жизнедеятельности, несмотря на имеющиеся симптомы заболевания; пациент способен выполнять свои обычные повседневные обязанности |
| 2 | Легкое нарушение функций жизнедеятельности; пациент неспособен выполнять ряд своих прежних обязанностей, но может еще справляться со своими делами без посторонней помощи |
| 3 | Нарушение жизнедеятельности умеренное по своей выраженности. Нуждается в некоторой помощи со стороны, но передвигается пешком (прогуливается) без посторонней помощи |
| 4 | Выраженное нарушение проявлений жизнедеятельности. Невозможность передвигаться самостоятельно (без помощи другого человека). Пациент не способен справляться со своими естественными потребностями без посторонней помощи |
| 5 | Грубое нарушение процессов жизнедеятельности. Пациент прикован к постели. Имеется недержание кала и мочи. Нуждается в постоянном внимании, помощи и уходе |
| 6 | Пациент умер |
Приложение Г10. Шкала Spetzler-Martin (1986)
- Название на русском языке: Шкала Spetzler-Martin
- Оригинальное название (если есть): Spetzler-Martin Scale
- Источник (официальный сайт разработчиков, публикация с валидацией): [40]
- Назначение: система классификации артериовенозных мальформаций
Содержание (шаблон) и ключ (интерпретация): АВМ 1-2 балла имеют низкий риск хирургического лечения, 3 балла – промежуточный, 4-5 баллов – высокий.
| Анатомическая форма АВМ | Количество баллов | |
|---|---|---|
| Максимальный размер АВМ | менее 3 см | 1 |
| 3-6 см | 2 | |
| более 6 см | 3 | |
| Наличие глубинного дренирования* | нет | 0 |
| да | 1 | |
| Локализация АВМ в функционально значимой зоне** | нет | 0 |
| да | 1 | |
Комментарий.
*Дренаж АВМ считают глубинным, если отток крови хотя бы по одной из вен происходит в вену Галена, внутренние вены мозга, базальные вены Розенталя и прецентральные мозжечковые вены.
**Функционально значимые зоны: сенсомоторная, речевая, зрительная кора, гипоталамус, таламус, внутренняя капсула, ствол мозга, ножки и глубокие ядра мозжечка.
Приложение Г11. Шкала Lawton-Young (2010)
- Название на русском языке: Шкала Lawton-Young
- Оригинальное название (если есть): Grading Scale for Selecting Patients with Brain Arteriovenous Malformations for Surgery
- Источник (официальный сайт разработчиков, публикация с валидацией): [42]
- Назначение: отбор пациентов с артериовенозными мальформациями головного мозга для хирургического вмешательства
Содержание (шаблон):
| Факторы риска хирургии АВМ | Количество баллов | |
|---|---|---|
| Возраст пациента | менее 20 лет | 1 |
| 20-40 лет | 2 | |
| более 40 лет | 3 | |
| Кровоизлияние в анамнезе | нет | 1 |
| да | 0 | |
| Размытость АВМ | нет | 0 |
| да | 1 | |
Ключ (интерпретация): при комбинации с классификацией Spetzler-Martin АВМ 2-6 баллов имеют низкий риск хирургического лечения, 7-10 баллов – высокий.
Приложение Г12. Шкала SICH в упрощенном виде (2010)
- Название на русском языке: Шкала SICH
- Оригинальное название (если есть): Secondary Intracerebral Hemorrhage Score
- Источник (официальный сайт разработчиков, публикация с валидацией): [75]
- Назначение: выявление пациентов с внутримозговым кровоизлиянием с самым высоким риском наличия основной сосудистой этиологии
Содержание (шаблон):
| Параметр | Количество баллов | |
|---|---|---|
| Вероятность аномалии сосудов по данным нативной КТ* | высокая | 2 |
| средняя | 1 | |
| низкая | 0 | |
| Возраст пациента (годы) | 18-45 | 2 |
| 46-70 | 1 | |
| 71 и более | 0 | |
| Пол | жен | 1 |
| муж | 0 | |
| Артериальная гипертензия и нарушения коагуляции** | нет | 1 |
| есть | 0 | |
Ключ (интерпретация):
Рекомендации для клиник, выполняющих КТ-ангиографию не всем больным с нетравматическими внутримозговыми кровоизлияниями:
- SICH 0 – КТА и ЦА не показаны.
- SICH 1-2 – выполняют КТА и лишь при наличии сосудистой патологии или подозрении на нее проводят ЦА.
- SICH 3-6 – выполняют ЦА без КТА
Рекомендация для клиник, в которых всем больным с ВМГ выполняют КТ-ангиографию.
- SICH 0-2 – ЦА проводят при наличии сосудистой патологии или подозрении на нее при КТА.
- SICH 3-6 – всем больным проводят ЦА вне зависимости от наличия патологии при КТА.
*К высокой вероятности наличия сосудистой аномалии по данным нативной КТ относят:
- расширенные сосуды или кальцинаты вдоль краев ВМГ;
- гипердесивные очаги в венозных синусах или в корковых венах на пути предполагаемого венозного дренирования ВМГ;
К низкому риску наличия сосудистой аномалии по данным КТ без контрастирования относят:
- отсутствие критериев высокого риска наличия сосудистой аномалии (см. выше);
- расположение ВМГ в подкорковых ядрах, таламусе или стволе мозга.
О среднем риске наличия сосудистой аномалии по данным КТ без контрастирования говорят при отсутствии критериев высокой и низкой вероятности наличия сосудистой аномалии (при лобарных и мозжечковых ВМГ).
**Критерии нарушения коагуляции по шкале SICH:
- ежедневный прием ацетилсалициловой кислоты** или клопидогреля**;
- тромбоцитопения менее 50 000 в 1 мкл;
- МНО более 3,0;
- активированное частичное тромбопластиновое время более 80 секунд.
Приложение Г13. Классификация Buffalo score (2015)
- Название на русском языке: Классификация Hunt-Hess
- Оригинальное название (если есть): Buffalo score
- Источник (официальный сайт разработчиков, публикация с валидацией): [46]
- Назначение: система оценки эндоваскулярного лечения церебральных артериовенозных мальформаций
Содержание (шаблон):
| Анатомическая форма АВМ | Количество баллов | |
|---|---|---|
| Количество ножек афферентов | 1-2 | 1 |
| 3-4 | 2 | |
| 5 и более | 3 | |
| Диаметр большинства ножек | более 1 мм | 0 |
| 1 мм и менее | 1 | |
| Локализация АВМ в функционально значимой зоне | нет | 0 |
| да | 1 | |
Ключ (интерпретация): при АВМ, оцененных в 1-2 балла по Buffalo score, риск осложнений отсутствует, в 3 балла – вероятность осложнений составляет 14%, в 4 балла – 50%, в 5 баллов – 75%
Приложение Г14. Классификация Virginia radiosurgery AVM scale (VRAS, 2013)
- Название на русском языке: Классификация VRAS
- Оригинальное название (если есть): Virginia radiosurgery AVM scale
- Источник (официальный сайт разработчиков, публикация с валидацией): [49]
- Назначение: прогнозирование исхода после радиохирургического лечения артериовенозных мальформаций
Содержание (шаблон):
| Анатомическая форма АВМ | Количество баллов | |
|---|---|---|
| Объем АВМ в мл | менее 2 | 0 |
| 2-4 | 1 | |
| более 4 | 2 | |
| Локализация АВМ в функционально значимой зоне | нет | 0 |
| да | 1 | |
| Кровоизлияние в анамнезе | нет | 0 |
| да | 1 | |
Ключ (интерпретация): При радиохирургии АВМ, оцененных в 0 баллов, отличный исход (полная облитерация АВМ без нарастания неврологических нарушений) прогнозируют в 83%, 1 балл – в 79%, 2 балла – в 70%, 3 балла – в 48%, 4 балла – в 39%.
Приложение Г15. Шкала RBAS (Radiosurgery-based AVM score), модифицированный вариант (2008)
- Название на русском языке: Шкала RBAS, модифицированный вариант (2008)
- Оригинальное название (если есть): Radiosurgery-based AVM score
- Источник (официальный сайт разработчиков, публикация с валидацией): [242].
- Назначение: прогнозирование исходов радиохирургического лечения пациентов с АВМ
Содержание (шаблон):
- Оценка АВМ = (0,1) x (объем АВМ в мл) + (0,02) x (возраст пациента в годах) + (0,5) x (расположение мальформации*).
Комментарий:
- *Локализация АВМ:
- 0 баллов – лобная и височная доли
- 1 балл – теменная, затылочная доли, внутрижелудочковое расположение, мозолистое тело и мозжечок
- 2 балла – базальные ядра, таламус, ствол мозга.
Ключ (интерпретация):
- при градации АВМ в 1 балл и менее отличный исход (полная облитерация АВМ без нарастания неврологических нарушений) прогнозируют в 95%, 1,25 балла – в 80%, 1,5 балла – в 70%, 1,75 балла – в 60%, 2 балла – в 50%, более 2 баллов – менее, чем в 40%.
Приложение Г16. Шкала Heidelberg score (2012)
- Название на русском языке: Шкала RBAS, модифицированный вариант (2008)
- Оригинальное название (если есть): Radiosurgery-based AVM score
- Источник (официальный сайт разработчиков, публикация с валидацией): [244]
- Назначение: определение вероятности облитерации АВМ при радиохирургическом лечении
Содержание (шаблон):
- 1 балл – возраст пациента 50 лет и менее и размер АВМ менее 3 см;
- 2 балла – возраст больного более 50 лет или размер мальформации 3 см и более;
- 3 балла – возраст пациента более 50 лет и размер мальформации 3 см и более.
Ключ (интерпретация): увеличение балла по данной шкале на 1 приводит к снижению вероятности облитерации на 44%.
ПриложениеГ17. Шкала PRAS (Proton radiosurgery AVM scale, 2014)
- Название на русском языке: Шкала RBAS, модифицированный вариант (2008)
- Оригинальное название (если есть): Radiosurgery-based AVM score
- Источник (официальный сайт разработчиков, публикация с валидацией): [243].
- Назначение: определение вероятности облитерации АВМ при радиохирургическом лечении
Содержание (шаблон):
- Градация АВМ = 0,26 x (объем АВМ в мл) + 0,7 x (локализация АВМ*)
*Локализация АВМ
- 0 баллов – поверхностные АВМ (лобная, височная, теменная, затылочная доли, внтурижелудочковая локализация, мозолистое тело, мозжечок).
- 1 балл – глубинная локализации АВМ (базальные ядра, таламус, ствол мозга).
Ключ (интерпретация):С увеличением результата оценки по данной классификации снижается вероятность облитерации АВМ.
Приложение Г18. Классификация Lawton (2003)
- Название на русском языке: Классификация Lawton (2003)
- Оригинальное название (если есть):
- Источник (официальный сайт разработчиков, публикация с валидацией): [249].
- Назначение: классификация артериовенозных мальформаций
Содержание (шаблон):
- S1V1E1 – мальформации размером менее 3 см, дренирующиеся в глубинные вены и расположенные в значимой зоне;
- S2V1E0 – АВМ 3 см и более с глубинным дренированием в незначимой зоне мозга;
- S2V0E1 – образования диаметром 3 см и более без глубинного венозного оттока в функционально значимой зоне;
- S3V0E0 – мальформации более 6 см без глубинных эфферентов вне важной зоны.
Ключ (интерпретация): АВМ S1V1E1 лечат хирургически, S2V0E1 – консервативно, мальформации S2V1E0 требуют индивидуального подхода.
Список литературы
- Крылов В.В., Дашьян В.Г., Буров А.С., Петриков С.С. Хирургия геморрагического инсульта. — М.: Медицина, 2012. — 336 с.
- Effect of Untreated Hypertension on Hemorrhagic Stroke / D. Woo [et all.] // Stroke.- 2004.- 35.- pp: 1703-8.
- Barnes, B. et all. Intracerebral hemorrhage secondary to vascular lesions / B. Barnes, C.M. Cawley, D.L. Barrow // Neurosurgery clinics of North America.- 2002.- Vol.13.- pp: 289-297.
- JE D. A., Romero J. M. Advanced CT imaging in the evaluation of hemorrhagic stroke //Neuroimaging clinics of North America. – 2011. – Т. 21. – №. 2. – С. 197-213, ix.
- Ворлоу, Ч.П. и др. Инсульт. Практическое руководство для ведения больных / Ч.П. Ворлоу [и др.].- СПБ.: Политехника, 1998.- 630 с.: ил.
- Skidmore, C.T. et all.Spontaneous intracerebral hemorrhage: epidemiology, pathophysiology, and medical management / C.T. Skidmore, J. Andrefsky // Neurosurgery clinics of north America.- 2002.- 13.- pp: 281 – 288.
- Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet. 1974. Vol. 304 (7872). P. 81–84. doi:10.1016/S0140-6736(74)91639-0.
- Hunt W. E., Hess R. M. Surgical risk as related to time of intervention in the repair of intracranial aneurysms. // J. Neurosurg. -1968. – vol. 28. – p. 14-20.
- Fisher CM, Kistler JP, Davis JM. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning. Neurosurgery 1980; 6:1–9.
- Frontera JA, Claassen J, Schmidt JM, et al. Prediction of symptomatic vasospasm after subarachnoid hemorrhage: the modified Fisher scale. Neurosurgery 2006; 59:21–27.
- Graeb DA, Robertson WD, Lapointe JS, Nugent RA, Harrison PB. Computed tomographic diagnosis of intraventricular hemorrhage. Etiology and prognosis. Radiology. 1982;143(1):91-6. D0I:10.1148/radiology.143.1.6977795.
- Элиава Ш. Ш., Яковлев.С.Б., Белоусова О. Б., Пилипенко Ю. В., Хейреддин А. С., Шехтман О. Д., Окишев Д. Н., Коновалов А. Н., Микеладзе К. Г., Арустамян С. Р., Бочаров А. В., Бухарин Е. Ю., Курдюмова Н. В., Табасаранский Т. Ф., Принципы выбора метода хирургического лечения больных в остром периоде разрыва церебральных аневризм. Журнал Вопросы нейрохирургии имени Н. Н. Бурденко. , 2016(№5.- Т80.): С. 15-22
- Пилипенко Ю.В., Коновалов Ан Н., Элиава Ш.Ш., Белоусова О.Б., Окишев Д.Н., Сазонов И.А., Табасаранский Т.Ф. Определение оправданности и эффективности декомпрессивной трепанации черепа у больных с субарахноидальным кровоизлиянием после микрохирургического выключения аневризм // Вопросы нейрохирургииимени Н.Н.Бурденко. — 2018. — № 1. — С. 59–71.
- Connolly E.S. Jr., Rabinstein A.A., Carhuapoma J.R., Derdeyn C.P., Dion J., Higashida R.T., Hoh B.L., Kirkness C.J., Naidech A.M., Ogilvy C.S., Patel A.B., Thompson B.G., Vespa P. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association // American Stroke Association Stroke — 2012. — 43(6) — P. 1711-1737.
- Diringer M.N., Bleck TP, Claude Hemphill J 3rd, Menon D, Shutter L, Vespa P, Bruder N, Connolly ES Jr, Citerio G, Gress D, Hänggi D, Hoh BL, Lanzino G, Le Roux P, Rabinstein A, Schmutzhard E, Stocchetti N, Suarez JI, Treggiari M, Tseng MY, Vergouwen MD, Wolf S, Zipfel G. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the Neurocritical Care Society»s Multidisciplinary Consensus Conference // Neurocrit. Care. — 2011. — 15(2) — P. 211-240.
- Fernández-L A. et al. Hereditary hemorrhagic telangiectasia, a vascular dysplasia affecting the TGF-β signaling pathway //Clinical medicine & research. – 2006. – Т. 4. – №. 1. – С. 66-78.
- Nishida T. et al. Brain arteriovenous malformations associated with hereditary hemorrhagic telangiectasia: gene–phenotype correlations //American Journal of Medical Genetics Part A. – 2012. – Т. 158. – №. 11. – С. 2829-2834.
- Saleh M. et al. Brain arteriovenous malformations in patients with hereditary hemorrhagic telangiectasia: clinical presentation and anatomical distribution //Pediatric neurology. – 2013. – Т. 49. – №. 6. – С. 445-450.
- Macmurdo C. F. et al. C., Teng, J. M., Bernstein, JA and Stevenson, DA 2016. RASA1 somatic mutation and variable expressivity in capillary malformation/arteriovenous malformation (CM/AVM) syndrome //Am. J. Med. Genet. – Т. 170. – С. 1450-1454.
- Morales-Valero S. F. et al. Are parenchymal AVMs congenital lesions? //Neurosurgical focus. – 2014. – Т. 37. – №. 3. – С. E2.
- Aboian M. S. et al. The putative role of the venous system in the genesis of vascular malformations //Neurosurgical focus. – 2009. – Т. 27. – №. 5. – С. E9.
- Aoun S. G., Bendok B. R., Batjer H. H. Acute management of ruptured arteriovenous malformations and dural arteriovenous fistulas //Neurosurgery Clinics. – 2012. – Т. 23. – №. 1. – С. 87-103.
- Duong D. H. et al. Feeding artery pressure and venous drainage pattern are primary determinants of hemorrhage from cerebral arteriovenous malformations //Stroke. – 1998. – Т. 29. – №. 6. – С. 1167-1176.
- Todaka T. et al. Analysis of mean transit time of contrast medium in ruptured and unruptured arteriovenous malformations: a digital subtraction angiographic study //Stroke. – 2003. – Т. 34. – №. 10. – С. 2410-2414.
- Graf C. J., Perret G. E., Torner J. C. Bleeding from cerebral arteriovenous malformations as part of their natural history //Journal of neurosurgery. – 1983. – Т. 58. – №. 3. – С. 331-337.
- Kim E. J. et al. The relationship of coexisting extranidal aneurysms to intracranial hemorrhage in patients harboring brain arteriovenous malformations //Neurosurgery. – 2004. – Т. 54. – №. 6. – С. 1349-1358.
- Mast H. et al. ‘Steal’is an unestablished mechanism for the clinical presentation of cerebral arteriovenous malformations //Stroke. – 1995. – Т. 26. – №. 7. – С. 1215-1220.
- Higgins J. N. P., Kirkpatrick P. J. Stenting venous outflow gives symptomatic improvement in a patient with an inoperable brainstem arteriovenous malformation //British journal of neurosurgery. – 2013. – Т. 27. – №. 5. – С. 698-700.
- Deng X. et al. Comparison of language cortex reorganization patterns between cerebral arteriovenous malformations and gliomas: a functional MRI study //Journal of neurosurgery. – 2015. – Т. 122. – №. 5. – С. 996-1003.
- Fierstra J. et al. Impaired peri-nidal cerebrovascular reserve in seizure patients with brain arteriovenous malformations //Brain. – 2011. – Т. 134. – №. 1. – С. 100-109.
- КоноваловА.Н., КрыловВ.В., ФилатовЮ.М., ЭлиаваШ.Ш., БелоусоваО.Б., ТкачевВ.В., ПарфеновВ.Е., СвистовД.В., АнтоновГ.И., ЛазаревВ.А., ИвановаН.Е., ПирадовМ.А., ПирскаяТ.Н., ЛапатухинВ.Г., СкороходА.А., КурдюмоваН.В., ЛубнинА.Ю., Цейтлин A.M. Рекомендательныйпротоколведениябольныхссубарахноидальнымкровоизлияниемвследствиеразрывааневризмголовногомозга. // ЖурналвопросынейрохирургииимН. Н. Бурденко. – 2006. — №3. – с. 3 – 11.
- КрыловВ.В., ДашьянВ.Г., ШатохинТ.А., ШетоваИ.М., ЭлиаваШ.Ш., БелоусоваО.Б., ОрловК.Ю., ДубовойА.В., АсратянС.А., КамбиевР.Л., ЧечуловП.В., МаксимовВ.В., КолотвиновВ.С., КравецЛ.Я., МячинН.Л., РодионовС.В., КосмачевМ.В., ЯхонтовИ.С., МожейкоР.А., КожаевЗ.У., ЕлфимовА.В., ШнякинП.Г., АлексеевА.Г., ХасаншинЭ.М., КушнирукП.И., ДедковД.С. ХирургическоелечениецеребральныханевризмвРоссийскойФедерации. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(6): 5-14.
- Michelsen W. J. Natural history and pathophysiology of arteriovenous malformations //Clinical neurosurgery. – 1979. – Т. 26. – С. 307-313.
- Al-Shahi R. et al. Prevalence of adults with brain arteriovenous malformations: a community based study in Scotland using capture-recapture analysis //Journal of Neurology, Neurosurgery & Psychiatry. – 2002. – Т. 73. – №. 5. – С. 547-551.
- Starke R. M. et al. Treatment guidelines for cerebral arteriovenous malformation microsurgery //British journal of neurosurgery. – 2009. – Т. 23. – №. 4. – С. 376-386.
- González-Duarte A. et al. Recurrent primary cerebral hemorrhage: frequency, mechanisms, and prognosis //Stroke. – 1998. – Т. 29. – №. 9. – С. 1802-1805.
- Stapf C. et al. Predictors of hemorrhage in patients with untreated brain arteriovenous malformation //Neurology. – 2006. – Т. 66. – №. 9. – С. 1350-1355.
- Kondziolka D., McLaughlin M. R., Kestle J. R. W. Simple risk predictions for arteriovenous malformation hemorrhage //Neurosurgery. – 1995. – Т. 37. – №. 5. – С. 851-855.
- Ogilvy C. S. et al. Recommendations for the management of intracranial arteriovenous malformations: a statement for healthcare professionals from a special writing group of the Stroke Council, American Stroke Association //Circulation. – 2001. – Т. 103. – №. 21. – С. 2644-2657.
- Spetzler R. F., Martin N. A. A proposed grading system for arteriovenous malformations //Journal of neurosurgery. – 1986. – Т. 65. – №. 4. – С. 476-483.
- UCSF Brain Arteriovenous Malformation Study Project Lawton Michael TMD lawtonm@ neurosurg. ucsf. edu. Spetzler-Martin Grade III arteriovenous malformations: surgical results and a modification of the grading scale //Neurosurgery. – 2003. – Т. 52. – №. 4. – С. 740-749.
- Lawton M. T. et al. A supplementary grading scale for selecting patients with brain arteriovenous malformations for surgery //Neurosurgery. – 2010. – Т. 66. – №. 4. – С. 702-713.
- Kim H. et al. Validation of the supplemented Spetzler-Martin grading system for brain arteriovenous malformations in a multicenter cohort of 1009 surgical patients //Neurosurgery. – 2015. – Т. 76. – №. 1. – С. 25-33.
- Frisoli F. A. et al. Spetzler-Martin Grade III Arteriovenous Malformations: A Comparison of Modified and Supplemented Spetzler-Martin Grading Systems //Neurosurgery. – 2021. – Т. 88. – №. 6. – С. 1103-1110.
- Spetzler R. F., Ponce F. A. A 3-tier classification of cerebral arteriovenous malformations //Journal of neurosurgery. – 2011. – Т. 114. – №. 3. – С. 842-849.
- Dumont T. M. et al. A proposed grading system for endovascular treatment of cerebral arteriovenous malformations: Buffalo score //Surgical neurology international. – 2015. – Т. 6.
- Pollock B. E., Flickinger J. C. A proposed radiosurgery-based grading system for arteriovenous malformations //Journal of neurosurgery. – 2002. – Т. 96. – №. 1. – С. 79-85.
- Pollock B. E., Flickinger J. C. Modification of the radiosurgery-based arteriovenous malformation grading system //Neurosurgery. – 2008. – Т. 63. – №. 2. – С. 239-243.
- Starke R. M. et al. A practical grading scale for predicting outcome after radiosurgery for arteriovenous malformations: analysis of 1012 treated patients //Journal of neurosurgery. – 2013. – Т. 119. – №. 4. – С. 981-987.
- Hattangadi-Gluth J. A. et al. Single-fraction proton beam stereotactic radiosurgery for cerebral arteriovenous malformations //International Journal of Radiation Oncology* Biology* Physics. – 2014. – Т. 89. – №. 2. – С. 338-346.
- Геморрагический инсульт: Практическое руководство / Под ред.В.И. Скворцовой, В.В. Крылова.- М.:ГЭОТАР – Медиа, 2005.-160 с.: ил.
- Крылов В. В., Дмитриев А. Ю. Клиника и диагностика артериовенозных мальформаций в остром периоде кровоизлияния. //Неврологический журнал. – 2008. – Т. 13. – №. 4. – С. 26-30.
- Fults D., Kelly Jr D. L. Natural history of arteriovenous malformations of the brain: a clinical study //Neurosurgery. – 1984. – Т. 15. – №. 5. – С. 658-662.
- Abdullah AR, Smith EE, Biddinger PD, Kalenderian D, Schwamm LH. Advance hospital notification by EMS in acute stroke is associated with shorter door-to-computed tomography time and increased likelihood of administration of tissue-plasminogen activator. Prehosp Emerg Care. 2008;12:426–431.
- Лебедев, В. В. и др. Неотложная нейрохирургия / В. В. Лебедев, В.В. Крылов // М.: Медицина.- 2000.- С. 506 – 530.
- Smith EE, Shobha N, Dai D, Olson DM, Reeves MJ, Saver JL, Hernandez AF, Peterson ED, Fonarow GC, Schwamm LH. A risk score for in-hospital death in patients admitted with ischemic or hemorrhagic stroke. J Am Heart Assoc. 2013;2:e005207.
- Bruce SS, Appelboom G, Piazza M, Hwang BY, Kellner C, Carpenter AM, Bagiella E, Mayer S, Connolly ES. A comparative evaluation of existing grading scales in intracerebral hemorrhage. Neurocrit Care. 2011;15:498–505.
- Allen C.M. Predicting the outcome of acute stroke: a prognostic score // J Neurol Neurosurg Psychiatry. 1984 May; 47(5): 475–480. doi: 10.1136/jnnp.47.5.475
- Cote R, Battista RN, Wolfson C, Boucher J, Adam J, and Hachinski VC. «The Canadian Neurological Scale: Validation and reliability assessment.» Neurology 1989; 39:638-643.
- Hage V. The NIH stroke scale: a window into neurological status. 2011; 24 (15): 44 – 49.
- Goldstein LB, Simel DL. Is this patient having a stroke? JAMA. 2005; 293:2391–2402.
- Comparison of MRI and CT for detection of acute intracerebral hemorrhage / C.S. Kidwell [et all.] // JAMA.- 2004 Oct.- 20.- 292(15).- pp:1823-30.
- Fiebach JB, Schellinger PD, Gass A, Kucinski T, Siebler M, Villringer A, Olkers P, Hirsch JG, Heiland S, Wilde P, Jansen O, Rother J, Hacke W, Sartor K. Stroke magnetic resonance imaging is accurate in hyperacute intracerebral hemorrhage: a multicenter study on the validity of stroke imaging. Stroke. 2004; 35(2):502–506.
- Chalela JA, Kidwell CS, Nentwich LM, Luby M, Butman JA, Demchuk AM, Hill MD, Patronas N, Latour L, Warach S. Magnetic resonance imaging and computed tomography in emergency assessment of patients with suspected acute stroke: a prospective comparison. Lancet. 2007; 369(9558):293–298.
- Divani A.A., Majidi S., Luo X. et al. The ABCs of Accurate Volumetric Measurement of Cerebral Hematoma. // Stroke. — 2011. — Vol. 42. — P. 1569-1574.
- 66. Montes J.M., Wong J.H., Fayad P.B., Awad I.A. // Stereotactic computedtomographic-guided aspiration and thrombolysis of intracerebral hematoma: protocol and preliminary experience // Stroke. — 2000. — Vol.31. — P.834 — 840.
- 67. Cho D.Y., Chen C.C., Chang C.S. et al. Endoscopic surgery for spontaneous basal ganglia hemorrhage: comparing endoscopic surgery, stereotactic aspiration, and craniotomy in noncomatose patients //Surg. Neurol. — 2006. — Vol.65.- P. 547-555.
- Cordonnier C. et al. Radiological investigation of spontaneous intracerebral hemorrhage: systematic review and trinational survey //Stroke. – 2010. – Т. 41. – №. 4. – С. 685-690.
- Donauer E. et al. Intraventricular haemorrhage caused by aneurysms and angiomas //Acta neurochirurgica. – 1993. – Т. 122. – №. 1-2. – С. 23-31.
- Almandoz J. E. D. et al. Diagnostic accuracy and yield of multidetector CT angiography in the evaluation of spontaneous intraparenchymal cerebral hemorrhage //American Journal of Neuroradiology. – 2009. – Т. 30. – №. 6. – С. 1213-1221.
- Delgado Almandoz JE, Jagadeesan BD, Moran CJ, Cross DT 3rd, Zipfel GJ, Lee JM, Romero JM, Derdeyn CP. Independent validation of the secondary intracerebral hemorrhage score with catheter angiography and findings of emergent hematoma evacuation. Neurosurgery. 2012;70:131–140.
- Yeung R, Ahmad T, Aviv RI, de Tilly LN, Fox AJ, Symons SP. Comparison of CTA to DSA in determining the etiology of spontaneous ICH. Can J Neurol Sci. 2009;36:176–180.
- Goddard A. J. P., Tan G., Becker J. Computed tomography angiography for the detection and characterization of intra-cranial aneurysms: current status //Clinical radiology. – 2005. – Т. 60. – №. 12. – С. 1221-1236.
- Delgado Almandoz J. E. et al. Systematic characterization of the computed tomography angiography spot sign in primary intracerebral hemorrhage identifies patients at highest risk for hematoma expansion: the spot sign score //Stroke. – 2009. – Т. 40. – №. 9. – С. 2994-3000.
- Almandoz J. E. D. et al. Practical scoring system for the identification of patients with intracerebral hemorrhage at highest risk of harboring an underlying vascular etiology: the Secondary Intracerebral Hemorrhage Score //American journal of neuroradiology. – 2010. – Т. 31. – №. 9. – С. 1653-1660.
- Perrini P. et al. Results of surgical and endovascular treatment of intracranial micro-arteriovenous malformations with emphasis on superselective angiography //Acta neurochirurgica. – 2004. – Т. 146. – №. 8. – С. 755-766.
- Derdeyn C. P. et al. Management of brain arteriovenous malformations: a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association //Stroke. – 2017. – Т. 48. – №. 8. – С. e200-e224.
- da Costa L. et al. The natural history and predictive features of hemorrhage from brain arteriovenous malformations //Stroke. – 2009. – Т. 40. – №. 1. – С. 100-105.
- Alexander M. D. et al. Association between venous angioarchitectural features of sporadic brain arteriovenous malformations and intracranial hemorrhage //American Journal of Neuroradiology. – 2015. – Т. 36. – №. 5. – С. 949-952.
- Sahlein D. H. et al. Features predictive of brain arteriovenous malformation hemorrhage: extrapolation to a physiologic model //Stroke. – 2014. – Т. 45. – №. 7. – С. 1964-1970.
- Stein K. P. et al. Associated aneurysms in supratentorial arteriovenous malformations: impact of aneurysm size on haemorrhage //Cerebrovascular Diseases. – 2015. – Т. 39. – №. 2. – С. 122-129.
- Schmidt N. O. et al. Clinical relevance of associated aneurysms with arteriovenous malformations of the posterior fossa //Trends in Neurovascular Surgery. – 2011. – С. 131-135.
- Redekop G. et al. Arterial aneurysms associated with cerebral arteriovenous malformations: classification, incidence, and risk of hemorrhage //Journal of neurosurgery. – 1998. – Т. 89. – №. 4. – С. 539-546.
- Kim E. J. et al. The relationship of coexisting extranidal aneurysms to intracranial hemorrhage in patients harboring brain arteriovenous malformations //Neurosurgery. – 2004. – Т. 54. – №. 6. – С. 1349-1358.
- Platz J. et al. Frequency, risk of hemorrhage and treatment considerations for cerebral arteriovenous malformations with associated aneurysms //Acta neurochirurgica. – 2014. – Т. 156. – №. 11. – С. 2025-2034.
- Suarez J. I. et al. Symptomatic vasospasm diagnosis after subarachnoid hemorrhage: evaluation of transcranial Doppler ultrasound and cerebral angiography as related to compromised vascular distribution //Critical care medicine. – 2002. – Т. 30. – №. 6. – С. 1348-1355.
- Элиава Ш.Ш., Шехтман О. Д., Табасаранский Т. Ф., Окишев Д. Н., Пронин И. Н., Пилипенко Ю. В., Микеладзе К. Г., Курдюмова Н. В., Коновалов Ан. Н., Варюхина М. Д., Абрамян А. А., Яковлев С. Б. Хирургическое лечение аневризм головного мозга в остром периоде кровоизлияния. Под ред. Ш. Ш. Элиава. — М.: Издательство ИП Т. А. Алексеева, 2019. – с. 232, илл. ISBN 978–5–905221–22–4.
- Molyneux AJ, Kerr RS, Yu LM, et al. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet. 2005;366:809–17.
- Choudhari KA, Ramachandran MS, Mc-Carron MO, Kaliaperumal C: Aneurysms unsuitable for endovascular intervention: surgical outcome and management challenges over a 5-year period following International Subarachnoid Haemorrhage Trial. Clin Neurol Neurosurg 2007;109:868–875.
- Крылов В. В., Дашьян В. Г., Шатохин Т. А., Шарифуллин Ф. А., Солодов А. А., Природов А. В., Левченко О. В., Токарев А. С., Хамидова Л. Т., Куксова Н. С., Айрапетян А. А., Калинкин А. А. Выбор сроков открытого хирургического лечения больных с разрывом церебральных аневризм, осложненных массивным базальным субарахноидальным кровоизлиянием (Fisher 3). // Нейрохирургия. – 2015. — №3. – с. 11-17.
- Bailes JE, Spetzler RF, Hadley MN, Baldwin HZ: Management, morbidity and mortality of poor-grade aneurysm patients. J Neurosurg 1990; 73: 559–566.
- Steiner T., Juvela S., Unterberg A., Jung C., Forsting M., Rinkel G., European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage // Cerebrovasc. Dis. — 2013. — 35(2) — P. 93-112.
- Spetzler R.F., McDougall C.G., Zabramski J.M., Albuquerque F.C., Hills N.K., Russin J.J., Partovi S., Nakaji P., Wallace R.C. The Barrow Ruptured Aneurysm Trial: 6-year results. J Neurosurg. 2015 Sep;123(3):609-17. doi: 10.3171/2014.9.JNS141749. Epub 2015 Jun 26. PubMed PMID: 26115467.
- Colby GP, Coon AL, Tamargo RJ. Surgical management of aneurysmal subarachnoid hemorrhage. Neurosurg Clin N Am. 2010 Apr;21(2):247-61. doi: 10.1016/j.nec.2009.10.003. PMID: 20380967.
- Lehecka M., Laakso A., Hernesniemi J. Helsinki Microneurosurgery. Basics and Tricks. Aesculap AG, Helsinki, 2011, 343 Pages.
- Элиава Ш. Ш., Шехтман О. Д., Пилипенко Ю. В., Окишев Д. Н., Хейреддин А. С., Кисарьев С. А., Кафтанов А. Н. Интраоперационная флуоресцентная ангиография с индоцианином в хирургии аневризм головного мозга. Первый опыт применения и обзор литературы Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко» 2015; 1: 33-41
- Крылов В. В., Григорьева Е. В. КТ-ангиография аневризм головного мозга. — М.:OOO «Принт-Студио», 2020 – 216 с.
- Young WL, Pile-Spellman J. Anesthetic considerations for interventional neuroradiology. Anesthesiology. 1994;80:427–456
- Manninen PH, Chan AS, Papworth D. Conscious sedation for interventional neuroradiology: a comparison of midazolam and propofol infusion. Can J Anaesth. 1997;44:26–30.
- Heros RC: Acute hydrocephalus after subarachnoid hemorrhage. Stroke 1989; 20: 715–717.
- Hasan D, Tanghe HL: Distribution of cisternal blood in patients with acute hydrocephalus after subarachnoid hemorrhage. Ann Neurol 1992; 31: 374–378.
- Chung DY, Mayer SA, Rordorf GA. External Ventricular Drains After Subarachnoid Hemorrhage: Is Less More? Neurocrit Care. 2018 Apr;28(2):157-161. doi: 10.1007/s12028-017-0443-2. PMID: 28929378; PMCID: PMC5858985.
- Пилипенко Ю.В., Элиава Ш.Ш., Шехтман О.Д., Хейреддин А.С. Локальный фибринолиз нетравматических внутримозговых и внутрижелудочковых кровоизлияний// Журнал вопросы нейрохирургии им. академика Н. Н. Бурденко. –Том: 76. Номер: 6 Год: 2012 Страницы: 3-13
- ДашьянВ.Г., ЛевченкоО.В., АйрапетянА.А., ЛукьянчиковВ.А., ТокаревА.С., ШатохинТ.А., КалинкинА.А., ШарифулинФ.А., КрыловВ.В. Декомпрессивнаякраниотомиявхирургииразорвавшихсяаневризмголовногомозга. Российский нейрохирургический журнал им. проф. А.Л. Поленова, Том VII, № 4, 2015, стр. 18-25
- Коновалов, А. Н., Белоусова, О. Б., Пилипенко, Ю. В., Элиава, Ш. Ш. Декомпрессивная трепанация черепа у больных с внутричерепным кровоизлиянием аневризматического генеза. Вопросы нейрохирургии имени Н.Н.Бурденко, 5 (2016).
- Ошоров А. В., Савин И. А., Горячев А. С. Внутричерепная гипертензия. Патофизиология. Мониторинг. Лечение. — ИП Волков А.А. Москва, 2021. — 657 с.
- Lee K. The NeuroICU Book, 2e Ed.. McGraw Hill, 2017, 1070 Pages.
- Dorfer C., Frick A., Knosp E., Gruber A. Decompressive hemicraniectomy after aneurysmal subarachnoid hemorrhage // World Neurosurg — 2010. — 74(4-5) — P. 465-471.
- Alotaibi NM, Wang JZ, Pasarikovski CR, Guha D, Al-Mufti F, Mamdani M, Saposnik G, Schweizer TA, Macdonald RL. Management of raised intracranial pressure in aneurysmal subarachnoid hemorrhage: time for a consensus? Neurosurg Focus. 2017 Nov;43(5):E13. doi: 10.3171/2017.7.FOCUS17426. PMID: 29088956.
- Mak CH, Lu YY, Wong GK. Review and recommendations on management of refractory raised intracranial pressure in aneurysmal subarachnoid hemorrhage. Vasc Health Risk Manag. 2013;9:353-9. doi: 10.2147/VHRM.S34046. Epub 2013 Jul 11. PMID: 23874101; PMCID: PMC3714000
- Buschmann U., Yonekawa Y., Fortunati M., Cesnulis E., Keller E. Decompressive hemicraniectomy in patients with subarachnoid hemorrhage and intractable intracranial hypertension / // Acta Neurochir (Wien) — 2007. — 149(1) — P. 59-65.
- Priebe HJ. Aneurysmal subarachnoid haemorrhage and the anaesthetist. Br J Anaesth 2007;99:102-18.
- Kundra S, Mahendru V, Gupta V, Choudhary AK. Principles of neuroanesthesia in aneurysmal subarachnoid hemorrhage. J Anaesthesiol Clin Pharmacol. 2014;30(3):328-337.
- Gruber A, Dorfer C, Standhardt H, Bavinzski G, Knosp E. Prospective comparison of intraoperative vascular monitoring technologies during cerebral aneurysm surgery. Neurosurgery 2011;68:657-73.
- Choi JW, Kim TS, Joo SP, Lee JK, Kim JH, Kim SH. Effect of temporary clipping on the cerebral infarction in middle cerebral artery aneurysm surgery. Korean J Cerebrovasc Surg 2006;8:248-53.
- Torre-Healy A, Marko NF, Weil RJ. Hyperosmolar therapy for intracranial hypertension. Neurocrit Care 2012;17:117-30.
- Dinsmore J. Anaesthesia for elective neurosurgery. Br J Anaesth 2007;99:68-74.
- El Beheiry H. Protecting the brain during neurosurgical procedures: Strategies that can work. Curr Opin Anaesthesiol 2012;25:548-55
- Dorhout Mees SM, Rinkel GJ, Feigin VL, Algra A, van den Bergh WM, Vermeulen M, van Gijn J. Calcium antagonists for aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev. 2007;(3):CD000277.
- Allen GS, Ahn HS, Preziosi TJ, Battye R, Boone SC, Boone SC, Chou SN, Kelly DL, Weir BK, Crabbe RA, Lavik PJ, Rosenbloom SB, Dorsey FC, Ingram CR, Mellits DE, Bertsch LA, Boisvert DP, Hundley MB, Johnson RK, Strom JA, Transou CR. Cerebral arterial spasm: a controlled trial of nimodipine in patients with subarachnoid hemorrhage. N Engl J Med. 1983;308:619–624
- Stechmiller JK, Cowan L, Whitney JD, Phillips L, Aslam R, Barbul A, Gottrup F, Gould L, Robson MC, Rodeheaver G, Thomas D, Stotts N. Guidelines for the prevention of pressure ulcers. Wound Repair Regen. 2008 Mar-Apr;16(2):151-68. doi: 10.1111/j.1524-475X.2008.00356.x. PMID: 18318801.
- Dennis M, Sandercock P, Reid J, Graham C, Murray G, Venables G, Rudd A, Bowler G; CLOTS Trials Collaboration. The effect of graduated compression stockings on long-term outcomes after stroke: the CLOTS trials 1 and 2. Stroke. 2013;44:1075–1079.
- Paciaroni M, Agnelli G, Venti M, Alberti A, Acciarresi M, Caso V. Efficacy and safety of anticoagulants in the prevention of venous thromboembolism in patients with acute cerebral hemorrhage: a meta-analysis of controlled studies. J Thromb Haemost. 2011;9:893–898.
- Collen JF, Jackson JL, Shorr AF, Moores LK. Prevention of venous thromboembolism in neurosurgery: a metaanalysis. Chest. 2008;134:237–49.
- Горячев А. С., Савин И. А. Основы ИВЛ. — Аксиом Графикс Юнион Москва, 2017. — 258 с. Издание седьмое, Москва, 2017.
- Fried HI, Nathan BR, Rowe AS, Zabramski JM, Andaluz N, Bhimraj A, Guanci MM, Seder DB, Singh JM. The insertion and management of external ventricular drains: an evidence-based consensus statement: a statement for healthcare professionals from the Neurocritical Care Society. Neurocrit Care. 2016;24:61–81
- Chung DY, Olson DM, John S, Mohamed W, Kumar MA, Thompson BB, Rordorf GA. Evidence-based management of external ventricular drains. Curr Neurol Neurosci Rep. 2019;19:94.
- Konovalov A, Shekhtman O, Pilipenko Y, Okishev D, Ershova O, Oshorov A, Abramyan A, Kurzakova I, Eliava S. External Ventricular Drainage in Patients With Acute Aneurysmal Subarachnoid Hemorrhage After Microsurgical Clipping: Our 2006-2018 Experience and a Literature Review. Cureus. 2021 Jan 27;13(1):e12951. doi: 10.7759/cureus.12951. PMID: 33643744; PMCID: PMC7885737.
- Lysakowski C, Walder B, Costanza MC, Tramer MR. Transcranial Doppler versus angiography in patients with vasospasm due to a ruptured cerebral aneurysm: a systematic review. Stroke. 2001;32:2292–8.
- Sloan MA, Alexandrov AV, Tegeler CH, et al. Assessment: transcranial Doppler ultrasonography: report of the therapeutics and technology assessment subcommittee of the American Academy of Neurology. Neurology. 2004;62:1468–81.
- Frontera JA, Fernandez A, Schmidt JM, et al. Defining vasospasm after subarachnoid hemorrhage: what is the most clinically relevant definition? Stroke. 2009;40:1963–8.
- Otsubo H, Takemae T, Inoue T, Kobayashi S, Sugita K. Normovolaemic induced hypertension therapy for cerebral vasospasm after subarachnoid haemorrhage. Acta Neurochir. 1990;103:18–26.
- Kosnik EJ, Hunt WE. Postoperative hypertension in the management of patients with intracranial arterial aneurysms. J Neurosurg. 1976;45:148–54.
- Zoerle T, Lombardo A, Colombo A, Longhi L, Zanier ER, Rampini P, Stocchetti N. Intracranial pressure after subarachnoid hemorrhage. Crit Care Med. 2015 Jan;43(1):168-76. doi: 10.1097/CCM.0000000000000670. PMID: 25318385.
- Harrigan MR. Cerebral salt wasting syndrome. Crit Care Clin. 2001; 17:125–138
- Mori T, Katayama Y, Kawamata T, Hirayama T. Improved efficiency of hypervolemic therapy with inhibition of natriuresis by fludrocortisone in patients with aneurysmal subarachnoid hemorrhage. J Neurosurg. 1999; 91:947–952.
- Quinn TJ, Dawson J, Walters MR, Lees KR. Functional outcome measures in contemporary stroke trials. Int J Stroke. 2009;4:200 –206.
- Qureshi AI, Palesch YY, Martin R, Novitzke J, Cruz-Flores S, Ehtisham A, Ezzeddine MA, Goldstein JN, Hussein HM, Suri MF, Tariq N; Antihypertensive Treatment of Acute Cerebral Hemorrhage Study Investigators. Effect of systolic blood pressure reduction on hematoma expansion, perihematomal edema, and 3-month outcome among patients with intracerebral hemorrhage: results from the Antihypertensive Treatment of Acute Cerebral Hemorrhage Study. Arch Neurol.2010;67:570–576.
- Anderson CS, Huang Y, Wang JG, Arima H, Neal B, Peng B, Heeley E, Skulina C, Parsons MW, Kim JS, Tao QL, Li YC, Jiang JD, Tai LW, Zhang JL, Xu E, Cheng Y, Heritier S, Morgenstern LB, Chalmers J; INTERACT Investigators. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT): a randomised pilot trial. Lancet Neurol. 2008;7:391–399.
- Anderson CS, Heeley E, Huang Y, Wang J, Stapf C, Delcourt C, Lindley R, Robinson T, Lavados P, Neal B, Hata J, Arima H, Parsons M, Li Y, Wang J, Heritier S, Li Q, Woodward M, Simes RJ, Davis SM, Chalmers J; INTERACT2 Investigators. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage. N Engl J Med. 2013;368:2355–2365.
- Moullaali TJ, Wang X, Martin RH, et al. Blood pressure control and clinical outcomes in acute intracerebral haemorrhage: a preplanned pooled analysis of individual participant data. Lancet Neurol. 2019;18(9):857-864.
- Hemphill JC, Greenberg SM, Anderson CS, et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2015;46(7):2032-2060.
- Frontera, Jennifer A.; Guideline for Reversal of Antithrombotics in Intracranial Hemorrhage: Executive Summary. A Statement for Healthcare Professionals From the Neurocritical Care Society and the Society of Critical Care Medicine, Critical Care Medicine: December 2016 — Volume 44 — Issue 12 — p 2251-2257
- Mayer SA, Brun NC, Begtrup K, Broderick J, Davis S, Diringer MN, Skolnick BE, Steiner T; Recombinant Activated Factor VII Intracerebral Hemorrhage Trial Investigators. Recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med. 2005;352:777–785.
- Mayer SA, Brun NC, Begtrup K, Broderick J, Davis S, Diringer MN, Skolnick BE, Steiner T; FAST Trial Investigators. Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhage. N Engl J Med. 2008;358:2127–2137.
- Wang Xia, Arima Hisatomi, Yang Jie, et al. Mannitol and Outcome in Intracerebral Hemorrhage. Stroke. 2015;46(10):2762-2767.
- Poungvarin N, Bhoopat W, Viriyavejakul A, Rodprasert P, Buranasiri P, Sukondhabhant S, Hensley MJ, Strom BL. Effects of dexamethasone in primary supratentorial intracerebral hemorrhage. N Engl J Med. 1987;316:1229–1233.
- The CLOTS (Clots in Legs Or sTockings after Stroke) Trial Collaboration. Thigh-length versus below-knee stockings for deep venous thrombosis prophylaxis after stroke: a randomized trial [published correction appears in Ann Intern Med. 2010;153:851]. Ann Intern Med. 2010;153:553–562
- Dennis M, Sandercock PA, Reid J, Graham C, Murray G, Venables G, Rudd A, Bowler G. CLOTS Trial Collaboration. Effectiveness of thigh-length graduated compression stockings to reduce the risk of deep vein thrombosis after stroke (CLOTS trial 1): a multicentre, randomized controlled trial. Lancet. 2009;373:1958–1965.
- Dennis M, Sandercock P, Reid J, Graham C, Forbes J, Murray G; CLOTS (Clots in Legs Or sTockings after Stroke) Trials Collaboration. Effectiveness of intermittent pneumatic compression in reduction of risk of deep vein thrombosis in patients who have had a stroke (CLOTS 3): a multicentre randomised controlled trial [published corrections appear in Lancet. 2013;382:506 and Lancet. 2013;382:1020]. Lancet. 2013;382:516–524.
- Salman RA-S, Dennis MS, Sandercock P a. G, et al. Effects of antiplatelet therapy after stroke due to intracerebral haemorrhage (RESTART): a randomised, open-label trial. The Lancet. 2019;393(10191):2613-2623.
- 152. Khosravani H., Mayer S.A., Demchuk A. et al. Emergency noninvasive angiography for acute intracerebral hemorrhage //AJNR Am. J. Neuroradiol. — 2013. — Vol. 34 (8). — P. 1481-1487.
- Kuo Lu-Ting, Chen Chien-Min, Li Chien-Hsun et al. Early endoscope- assisted hematoma evacuation in patients with supratentorial intracerebral hemorrhage: case selection, surgical technique, and longterm results // Focus Neurosurg. — 2011. — Vol. 30 (4). — P. 1-8.
- Lee H.S., Lee K.S., Bae H.G. et al. Clinical course of spontaneous gangliotalamic hemorrhage in the acute period — who requires surgical removal? // J. Korean Med. Sci. — 1991. — Vol. 6 (2). — P. 103-111.
- Wang Z.F., Liu F., Liao D.G., Zhang T.Y. Endoscopic surgery forhypertensive cerebral hemorrhage // Zhong Nan Da Xue Bao Yi Xue Ban. — 2005. — Vol. 30. — P. 424 — 426.
- Zhu H., Wang Z., Shi W. Keyhole endoscopic hematoma evacuation in patients // Turkish Neurosurgery. — 2012. — Vol. 22. — P. 294 — 299.
- Крылов В.В., Дашьян В.Г., Годков И.М. Эндоскопическая хирургия геморрагического инсульта. — М.: Бином, 2014. — 96 с.
- Auer L.M., Deinsberger W., Niederkorn K. et al // Endoscopic surgery versus medical treatment for spontaneous intracerebral hematoma: a randomized study // J. Neurosurg. — 1989. — Vol. 70 (4). — P. 530-535.
- Zuccarello M., Brott T., Derex L. et al. // Early Surgical Treatment for Supratentorial Intracerebral Hemorrhage // Stroke. — 1999. — Vol. 30. – P. 1833-1839.
- Dye J.A., Dusick J.R., Lee D.J. et al. Frontal bur hole through an eyebrow incision for image-guided endoscopic evacuation of spontaneous intracerebral hemorrhage // J. Neurosurg. — 2012. — Vol. 117. — P. 767 — 773.
- Mendelow A.D. The International Surgical Trial in Intracerebral Haemorrhage (ISTICH). // Acta Neurochir. Suppl. — 2003. — Vol. 86. — P. 441-443.
- Morgenstern L.B., Hemphill III J.C., Anderson C. et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the american heart association/American stroke association // Stroke. — 2010. — Vol. 41. — P. 2108-2129.
- Rabinstein A.A., Atkinson J.L., Wijdicks E.F. // Emergency craniotomy in patients worsening due to expanded cerebral hematoma: to what purpose? // Neurology. — 2002. — Vol. 58 (9). — P. 1367-1372.
- Wakai S., Kumakura N., Nagai M. Lobar intracerebral hemorrhage. A clinical, radiographic, and pathological study of 29 consecutive operated cases with negative anriografy // J. Neurosurg. — 1992. — Vol. 76 (2). — P. 231-238.
- 165. van Loon J., Van Calenbergh F., Goffin J., Plets C. Controversies in the management of spontaneous cerebellar haemorrhage: a consecutive series of 49 cases and review of the literature // Acta Neurochir (Wien). — 1993. — Vol. 122. — P. 187-193.
- Gaberel T., Magheru C., Parienti J.J. et al. Intraventricular fibrinolysis versus external ventricular drainage alone in intraventricular hemorrhage: a meta-analysis // Stroke. — 2011. — Vol. 42 (2). — P. 27762781.
- Крылов В.В., Буров С.А., Галанкина И.Е., Дашьян В.Г. Пункционная аспирация и локальный фибринолиз в хирургии внутричерепных кровоизлияний. — М.: Авторская Академия; Товарищество научных изданий КМК. 2009.- 160 с.
- Сарибекян А.С. Хирургическое лечение геморрагического инсульта методом пункционной аспирации и локального фибринолиза. — М.: Летопись, 2009. – 288c.
- Nasser J.A., Falavigna A., Bezerra M. et al. Stereotactic fibrinolysis of spontaneous intracerebral hematoma using infusion of recombinant tissue plasminogen activator // Arh. Neuropsiquiatr. — 2002. — Vol. 60 (2-B). — P. 362-366.
- Teernstra O., Evers S., Lodder J. et al. Stereotactic Treatment of Intracerebral Hematoma by Means of a Plasminogen Activator. A Multicenter Randomized Controlled Trial (SICHPA) // Stroke. — 2003. — Vol. 34. — P. 968.
- Pantazis G. et al. Early surgical treatment vs conservative management for spontaneous supratentorial intracerebral hematomas: a prospective randomized study //Surgical neurology. – 2006. – Т. 66. – №. 5. – С. 492-501.
- Kuhmonen J. et al. Early surgery for ruptured cerebral arteriovenous malformations //New Trends of Surgery for Stroke and its Perioperative Management. – Springer, Vienna, 2005. – С. 111-114.
- Ashley Jr W. W., Charbel F. T., Amin-Hanjani S. Surgical management of acute intracranial hemorrhage, surgical aneurysmal and arteriovenous malformation ablation, and other surgical principles //Neurologic clinics. – 2008. – Т. 26. – №. 4. – С. 987-1005.
- Beecher J. S. et al. Delayed treatment of ruptured brain AVMs: is it ok to wait? //Journal of neurosurgery. – 2018. – Т. 128. – №. 4. – С. 999-1005.
- Morgan M. K. et al. The failure of ethylene-vinyl alcohol copolymer embolization to improve outcomes in AVM management: case series //J Neurosurg. – 2013. – Т. 118. – №. 5. – С. 969-977.
- Potts M. B. et al. Curing arteriovenous malformations using embolization //Neurosurgical focus. – 2014. – Т. 37. – №. 3. – С. E19.
- Wong J. et al. Microsurgery for ARUBA trial (a randomized trial of unruptured brain arteriovenous malformation)–eligible unruptured brain arteriovenous malformations //Stroke. – 2017. – Т. 48. – №. 1. – С. 136-144.
- Friedman W. A., Bova F. J. Radiosurgery for arteriovenous malformations //Neurological research. – 2011. – Т. 33. – №. 8. – С. 803-819.
- Sahlein D. H. et al. Nidal embolization of brain arteriovenous malformations: rates of cure, partial embolization, and clinical outcome //Journal of neurosurgery. – 2012. – Т. 117. – №. 1. – С. 65-77.
- Valavanis A., Yasargil M. G. The endovascular treatment of brain arteriovenous malformations //Advances and technical standards in neurosurgery. – Springer, Vienna, 1998. – С. 131-214.
- Pierot L. et al. Endovascular treatment of brain arteriovenous malformations using a liquid embolic agent: results of a prospective, multicentre study (BRAVO) //European radiology. – 2013. – Т. 23. – №. 10. – С. 2838-2845.
- Saatci I. et al. Endovascular treatment of brain arteriovenous malformations with prolonged intranidal Onyx injection technique: long-term results in 350 consecutive patients with completed endovascular treatment course //Journal of neurosurgery. – 2011. – Т. 115. – №. 1. – С. 78-88.
- Yuki I. et al. Treatment of brain arteriovenous malformations with high-flow arteriovenous fistulas: risk and complications associated with endovascular embolization in multimodality treatment //Journal of neurosurgery. – 2010. – Т. 113. – №. 4. – С. 715-722.
- Van Rooij W. J. et al. Endovascular treatment of ruptured brain AVMs in the acute phase of hemorrhage //American journal of neuroradiology. – 2012. – Т. 33. – №. 6. – С. 1162-1166.
- Loh Y. Onyx Trial Investigators: A prospective, multicenter, randomized trial of the Onyx liquid embolic system and N-butyl cyanoacrylate embolization of cerebral arteriovenous malformations. Clinical article //J Neurosurg. – 2010. – Т. 113. – С. 733-741.
- Gioppo A. et al. Medial tentorial dural arteriovenous fistula embolization: single experience with embolic liquid polymer SQUID and review of the literature //World neurosurgery. – 2017. – Т. 107. – С. 1050. e1-1050. e7.
- Varadharajan S. et al. Precipitating hydrophobic injectable liquid embolization of intracranial vascular shunts: initial experience and technical note //Journal of neurosurgery. – 2017. – Т. 129. – №. 5. – С. 1217-1222.
- Chen C. J. et al. Transvenous embolization of brain arteriovenous malformations: a review of techniques, indications, and outcomes //Neurosurgical focus. – 2018. – Т. 45. – №. 1. – С. E13.
- Rubin B. A. et al. Advances in radiosurgery for arteriovenous malformations of the brain //Neurosurgery. – 2014. – Т. 74. – №. suppl_1. – С. S50-S59.
- Moosa S. et al. Volume-staged versus dose-staged radiosurgery outcomes for large intracranial arteriovenous malformations //Neurosurgical focus. – 2014. – Т. 37. – №. 3. – С. E18.
- Ding D. et al. Radiosurgery for ruptured intracranial arteriovenous malformations //Journal of neurosurgery. – 2014. – Т. 121. – №. 2. – С. 470-481.
- Milker-Zabel S. et al. Proposal for a new prognostic score for linac-based radiosurgery in cerebral arteriovenous malformations //International Journal of Radiation Oncology* Biology* Physics. – 2012. – Т. 83. – №. 2. – С. 525-532.
- Morgan M. K. et al. Surgical risks associated with the management of Grade I and II brain arteriovenous malformations //Neurosurgery. – 2004. – Т. 54. – №. 4. – С. 832-839.
- Davidson A. S., Morgan M. K. How safe is arteriovenous malformation surgery? A prospective, observational study of surgery as first-line treatment for brain arteriovenous malformations //Neurosurgery. – 2010. – Т. 66. – №. 3. – С. 498-505.
- Potts M. B. et al. Current surgical results with low-grade brain arteriovenous malformations //Journal of neurosurgery. – 2015. – Т. 122. – №. 4. – С. 912-920.
- Cenzato M. et al. European consensus conference on unruptured brain AVMs treatment (Supported by EANS, ESMINT, EGKS, and SINCH) //Acta neurochirurgica. – 2017. – Т. 159. – №. 6. – С. 1059-1064.
- UCSF Brain Arteriovenous Malformation Study Project Lawton Michael TMD lawtonm@ neurosurg. ucsf. edu. Spetzler-Martin Grade III arteriovenous malformations: surgical results and a modification of the grading scale //Neurosurgery. – 2003. – Т. 52. – №. 4. – С. 740-749.
- Ding D., Ilyas A., Sheehan J. P. Contemporary management of high-grade brain arteriovenous malformations //Neurosurgery. – 2018. – Т. 65. – №. CN_suppl_1. – С. 24-33.
- Han P. P., Ponce F. A., Spetzler R. F. Intention-to-treat analysis of Spetzler—Martin Grades IV and V arteriovenous malformations: natural history and treatment paradigm //Journal of neurosurgery. – 2003. – Т. 98. – №. 1. – С. 3-7.
- Niini T. et al. Perioperative treatment of brain arteriovenous malformations between 2006 and 2014: the Helsinki Protocol //Neurocritical care. – 2019. – Т. 31. – №. 2. – С. 346-356.
- Morgan M. K. et al. Deliberate employment of postoperative hypotension for brain arteriovenous malformation surgery and the incidence of delayed postoperative hemorrhage: a prospective cohort study //Journal of neurosurgery. – 2016. – Т. 127. – №. 5. – С. 1025-1040.
- Rangel-Castilla L., Spetzler R. F., Nakaji P. Normal perfusion pressure breakthrough theory: a reappraisal after 35 years //Neurosurgical review. – 2015. – Т. 38. – №. 3. – С. 399-405.
- Karbe A. G., Vajkoczy P. Postoperative management and follow-up after resection of arteriovenous malformations //Journal of neurosurgical sciences. – 2018. – Т. 62. – №. 4. – С. 484-489.
- Torné R., Rodríguez-Hernández A., Lawton M. T. Intraoperative arteriovenous malformation rupture: causes, management techniques, outcomes, and the effect of neurosurgeon experience //Neurosurgical focus. – 2014. – Т. 37. – №. 3. – С. E12.
- Graffeo C. S. et al. Stereotactic radiosurgery for Spetzler-Martin grade I and II arteriovenous malformations: International Society of Stereotactic Radiosurgery (ISRS) practice guideline //Neurosurgery. – 2020. – Т. 87. – №. 3. – С. 442-452.
- Kelley R. E., Borazanci A. P. Stroke rehabilitation //Neurological research. – 2009. – Т. 31. – №. 8. – С. 832-840.
- Cho WS, Kim JE, Park SQ, Ko JK, Kim DW, Park JC, Yeon JY, Chung SY, Chung J, Joo SP, Hwang G, Kim DY, Chang WH, Choi KS, Lee SH, Sheen SH, Kang HS, Kim BM, Bae HJ, Oh CW, Park HS; Quality Control Committees from the Korean Society of Cerebrovascular Surgeons; Society of Korean Endovascular Neurosurgeons; Korean Society of Interventional Neuroradiology; Korean Stroke Society and Korean Academy of Rehabilitation Medicine. Korean Clinical Practice Guidelines for Aneurysmal Subarachnoid Hemorrhage. J Korean Neurosurg Soc. 2018 Mar;61(2):127-166.
- Thompson BG, Brown RD Jr, Amin-Hanjani S, Broderick JP, Cockroft KM, Connolly ES Jr, Duckwiler GR, Harris CC, Howard VJ, Johnston SC, Meyers PM, Molyneux A, Ogilvy CS, Ringer AJ, Torner J; American Heart Association Stroke Council, Council on Cardiovascular and Stroke Nursing, and Council on Epidemiology and Prevention; American Heart Association; American Stroke Association. Guidelines for the Management of Patients With Unruptured Intracranial Aneurysms: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2015 Aug;46(8):2368-400.
- Committee for Guidelines for Management of Aneurysmal Subarachnoid Hemorrhage, Japanese Society on Surgery for Cerebral Stroke. Evidence-based guidelines for the management of aneurysmal subarachnoid hemorrhage. English Edition. Neurol Med Chir (Tokyo). 2012;52(6):355-429.
- Hijdra, A. et al. “Grading The Amount Of Blood On Computed Tomograms After Subarachnoid Hemorrhage”. Stroke 21.8 (1990): 1156-1161. Web.
- Roy D, Milot G, Raymond J. Endovascular treatment of unruptured aneurysms. Stroke 2001;32:1998–2004.
- Hemphill J.C. et al. The ICH score. A simple, reliable grading scale for intracerebral hemorrhage / // Stroke. – 2001. – Vol. 32, N. 4. – P. 891- 897.
- Starke R. M. et al. Evaluation of a revised Glasgow Coma Score scale in predicting long-term outcome of poor grade aneurysmal subarachnoid hemorrhage patients //Journal of clinical neuroscience. – 2009. – Т. 16. – №. 7. – С. 894-899.
- Mayda-Domaç F., Mısırlı H., Yılmaz M. Prognostic role of mean platelet volume and platelet count in ischemic and hemorrhagic stroke //Journal of Stroke and Cerebrovascular Diseases. – 2010. – Т. 19. – №. 1. – С. 66-72.
- Du J. et al. Association of mean platelet volume and platelet count with the development and prognosis of ischemic and hemorrhagic stroke //International journal of laboratory hematology. – 2016. – Т. 38. – №. 3. – С. 233-239.
- Morbitzer K. A. et al. Enhanced renal clearance in patients with hemorrhagic stroke //Critical care medicine. – 2019. – Т. 47. – №. 6. – С. 800-808.
- Iribarren C. et al. Low total serum cholesterol and intracerebral hemorrhagic stroke: is the association confined to elderly men? The Kaiser Permanente Medical Care Program //Stroke. – 1996. – Т. 27. – №. 11. – С. 1993-1998.
- Wang Y. et al. Retrospective analysis of the predictive effect of coagulogram on the prognosis of intracerebral hemorrhage //Intracerebral Hemorrhage Research. – Springer, Vienna, 2011. – С. 383-385.
- Tsementzis S. A. et al. Reduced platelet function in subarachnoid hemorrhage //Journal of neurosurgery. – 1986. – Т. 64. – №. 6. – С. 907-910.
- Ziai W. C. et al. Platelet count and function in spontaneous intracerebral hemorrhage //Journal of Stroke and Cerebrovascular Diseases. – 2003. – Т. 12. – №. 4. – С. 201-206.
- Lee J. J. et al. Subdural hematoma as a major determinant of short-term outcomes in traumatic brain injury //Journal of neurosurgery. – 2017. – Т. 128. – №. 1. – С. 236-249.
- Buruma O. J. et al. Blood-stained cerebrospinal fluid: traumatic puncture or haemorrhage? //Journal of Neurology, Neurosurgery & Psychiatry. – 1981. – Т. 44. – №. 2. – С. 144-147.
- Westerlaan H. E. et al. Intracranial aneurysms in patients with subarachnoid hemorrhage: CT angiography as a primary examination tool for diagnosis—systematic review and meta-analysis //Radiology. – 2011. – Т. 258. – №. 1. – С. 134-145.
- Sailer A. M. H. et al. Diagnosing intracranial aneurysms with MR angiography: systematic review and meta-analysis //Stroke. – 2014. – Т. 45. – №. 1. – С. 119-126.
- Poon W. S. Spontaneous intracranial hemorrhage: which patients need diagnostic cerebral angiography? A prospective study of 206 cases and review of the literature //Stroke. – 1997. – Т. 28. – №. 7. – С. 1406-1409.
- Tommasino N. et al. Epidemiologic and evolutionary profile of patients with subarachnoid hemorrhage with Glasgow Coma Scale score of 8 or less who entered the follow-up program of the National Institute of Donation and Transplantation //Transplantation proceedings. – Elsevier, 2018. – Т. 50. – №. 2. – С. 405-407.
- Oshiro E. M. et al. A new subarachnoid hemorrhage grading system based on the Glasgow Coma Scale: a comparison with the Hunt and Hess and World Federation of Neurological Surgeons Scales in a clinical series //Neurosurgery. – 1997. – Т. 41. – №. 1. – С. 140-148.
- Di Rienzo A. et al. Endoscope-assisted microsurgical evacuation versus external ventricular drainage for the treatment of cast intraventricular hemorrhage: results of a comparative series //Neurosurgical review. – 2020. – Т. 43. – №. 2. – С. 695-708.
- Chestnut J. S. et al. Clinical evaluation of intravenous nitroglycerin for neurosurgery //Journal of neurosurgery. – 1978. – Т. 48. – №. 5. – С. 704-711.УДД 4 УУР С
- Gigante P. et al. External ventricular drainage following aneurysmal subarachnoid haemorrhage //British journal of neurosurgery. – 2010. – Т. 24. – №. 6. – С. 625-632.
- Manzanares W. et al. Hyponatremia in the neurocritical care patient: an approach based on current evidence //Medicina Intensiva (English Edition). – 2015. – Т. 39. – №. 4. – С. 234-243.
- Mori T. et al. Improved efficiency of hypervolemic therapy with inhibition of natriuresis by fludrocortisone in patients with aneurysmal subarachnoid hemorrhage //Journal of neurosurgery. – 1999. – Т. 91. – №. 6. – С. 947-952.
- Poole D. et al. Evidence for mannitol as an effective agent against intracranial hypertension: an individual patient data meta-analysis //Neurocritical care. – 2020. – Т. 32. – №. 1. – С. 252-261.
- Kelly J. et al. Anticoagulation or inferior vena cava filter placement for patients with primary intracerebral hemorrhage developing venous thromboembolism? //Stroke. – 2003. – Т. 34. – №. 12. – С. 2999-3005.
- White R. H. et al. A population-based study of the effectiveness of inferior vena cava filter use among patients with venous thromboembolism //Archives of internal medicine. – 2000. – Т. 160. – №. 13. – С. 2033-2041.
- Pessin M. S. et al. Safety of anticoagulation after hemorrhagic infarction //Neurology. – 1993. – Т. 43. – №. 7. – С. 1298-1298.
- Yung D. et al. Reinitiation of anticoagulation after warfarin-associated intracranial hemorrhage and mortality risk: the Best Practice for Reinitiating Anticoagulation Therapy After Intracranial Bleeding (BRAIN) study //Canadian Journal of Cardiology. – 2012. – Т. 28. – №. 1. – С. 33-39.
- Phan T. G., Koh M., Wijdicks E. F. M. Safety of discontinuation of anticoagulation in patients with intracranial hemorrhage at high thromboembolic risk //Archives of neurology. – 2000. – Т. 57. – №. 12. – С. 1710-1713.
- Majeed A. et al. Optimal timing of resumption of warfarin after intracranial hemorrhage //Stroke. – 2010. – Т. 41. – №. 12. – С. 2860-2866.
- Крылов В. В. и др. Метод локального фибринолиза в хирургии нетравматических внутричерепных кровоизлияний //Вестник Российской академии медицинских наук. – 2013. – Т. 68. – №. 7.
- Graffeo C. S. et al. Stereotactic radiosurgery for Spetzler-Martin grade I and II arteriovenous malformations: International Society of Stereotactic Radiosurgery (ISRS) practice guideline //Neurosurgery. – 2020. – Т. 87. – №. 3. – С. 442-452.
- Meng X. et al. Radiosurgery-based AVM scale is proposed for combined embolization and gamma knife surgery for brain arteriovenous malformations //Frontiers in Neurology. – 2021. – Т. 12.
- Hattangadi-Gluth J. A. et al. Single-fraction proton beam stereotactic radiosurgery for cerebral arteriovenous malformations //International Journal of Radiation Oncology* Biology* Physics. – 2014. – Т. 89. – №. 2. – С. 338-346.
- Milker-Zabel S. et al. Proposal for a new prognostic score for linac-based radiosurgery in cerebral arteriovenous malformations //International Journal of Radiation Oncology* Biology* Physics. – 2012. – Т. 83. – №. 2. – С. 525-532.
- Drake C. G. Report of World Federation of Neurological Surgeons Committee on a universal subarachnoid hemorrhage grading scale //J neurosurg. – 1988. – Т. 68. – С. 985-986
- Suponeva N. A. et al. Validation of the modified Rankin Scale in Russia //Neurology, Neuropsychiatry, Psychosomatics. – 2018. – Т. 10. – №. 4. – С. 36-39.
- Rosen D. S., Macdonald R. L. Subarachnoid hemorrhage grading scales //Neurocritical care. – 2005. – Т. 2. – №. 2. – С. 110-118.
- Голанов А. В., Костюченко В. В. Нейрохирургия на Гамма-Ноже. – 2018.-708с.
- Lawton M. T. UCSF Brain Arteriovenous Malformation Study Project: Spetzler-Martin Grade III arteriovenous malformations: Surgical results and a modification of the grading scale //Neurosurgery. – 2003. – Т. 52. – С. 740-748.
- Haller J. T. et al. Acute management of hypertension following intracerebral hemorrhage //Critical care nursing quarterly. – 2019. – Т. 42. – №. 2. – С. 129-147.С
- Chen J. et al. Comparison of the Effects of Sufentanil/Fentanyl Combined with Propofol on Stress Responses and Hemodynamics in Patients with Hypertensive Intracerebral Hemorrhage //Indian Journal of Pharmaceutical Sciences. – 2022. – С. 190-195
- Bauer, C., Kreuer, S., Ketter, R., Grundmann, U., & Wilhelm, W. (2007). Remifentanil-Propofol- versus Fentanyl-Midazolam-Kombination bei intrakraniellen Eingriffen. Der Anaesthesist, 56(2), 128–132. doi:10.1007/s00101-006-1130-4
